Nature Cancer:三联免疫疗法有可能治疗胰腺癌
德克萨斯大学MD安德森癌症中心的研究人员发现了一种新的免疫治疗组合,靶向T细胞和骨髓抑制细胞中的检查点,成功地重新编程了肿瘤免疫微环境(TIME),并显著改善了胰腺癌临床前模型中的抗肿瘤反应。
在今天发表在《Nature Cancer》杂志上的这项研究中,研究人员对小鼠和人类胰腺癌进行了全面的免疫分析,系统地确定了免疫治疗耐药的机制,并研究了潜在的治疗靶点。他们发现,中和TIME的几种不同的免疫抑制机制,极大地提高了实验室模型的存活率,为这种臭名昭著的致命和无反应的癌症指明了一种潜在的治疗方案。
“在我们的模型中,这种三联疗法导致了前所未有的疗效反应,”通讯作者、癌症生物学教授Ronald DePinho博士说。“普遍的观点是,胰腺癌不受免疫治疗的影响,但这项临床前研究表明,它可能容易受到正确的联合治疗的影响。此外,这些靶点在人类胰腺癌标本中的存在,提出了一种令人兴奋的可能性,即这种治疗组合有朝一日可以帮助我们的患者。”
胰腺癌是美国癌症死亡的主要原因之一,部分原因是80%的病例是在晚期被诊断出来的。胰腺癌也被认为是“非免疫原性的”,这意味着它对常用的抗PD-1和抗CTLA-4免疫检查点抑制剂无反应。这在一定程度上是由于TIME中的免疫抑制条件,但这种耐药性背后的机制尚不完全清楚。
研究人员使用高维免疫谱分析和单细胞RNA测序来研究各种免疫疗法对TIME的影响。他们发现了特定的免疫检查点蛋白41BB和LAG,它们在耗尽的T细胞中高度表达。
在测试针对这些检查点的抗体时,研究人员观察到,与单独使用抗体或其他检查点抑制剂相比,使用41BB激动剂和LAG3拮抗剂联合治疗的模型具有更慢的肿瘤进展,更高水平的抗肿瘤免疫指标和显著提高的生存率。值得注意的是,这些临床前研究忠实地反映了抗PD-1和抗CTLA-4治疗缺乏疗效的人类数据。
研究人员还证实,这两个治疗靶点存在于人类胰腺癌样本中,分别有81%和93%的患者携带41BB和LAG3表达的T细胞。
由于这种双重治疗组合并没有完全消除已建立的肿瘤,研究人员还检查了重新编程TIME以进一步使肿瘤对免疫治疗敏感的努力。在基线时,TIME含有大量表达CXCR2的髓源性抑制细胞(MDSCs), CXCR2是一种与招募免疫抑制细胞相关的蛋白质。仅抑制CXCR2可减少MDSC迁移并阻止肿瘤生长,但不能治愈。这促使研究人员考虑针对41BB、LAG3和CXCR2的组合。
在90%的临床前模型中,正是这三种组合导致了肿瘤的完全消退和总生存率的提高。在一个更严格的实验室模型中,该组合在超过20%的病例中实现了肿瘤完全消退。
DePinho说:“这些结果令人鼓舞,特别是考虑到胰腺癌缺乏有效的免疫治疗方案。通过靶向多种阻碍免疫反应的协同机制,我们可以给T细胞一个攻击这些肿瘤的战斗机会。当然,我们仍然需要看看这种组合如何在临床中转化为安全有效的治疗方案,我们邀请其他研究人员在这些结果的基础上进行研究。我们乐观地认为,胰腺癌,以及其他非免疫源性癌症,最终可以通过联合免疫治疗变得脆弱。”
作者指出,这些特定的免疫疗法目前正在作为单一疗法进行临床试验,这表明有可能将这种三联疗法迅速转化为临床研究。
- 上一篇
一种历史悠久的疾病居然能使肝脏再生!
麻风病是由麻风分枝杆菌引起的一种慢性传染病,是世界上最古老和最持久的疾病之一。它会影响皮肤、神经和粘膜,如果不及时治疗,可能会导致严重的毁容和残疾。然而,新的令人惊讶的研究表明,导致麻风病的细菌可能也有能力刺激成年动物肝脏的生长和再生,而不会造成损害或疤痕。科学家们发现,与麻风病有关的寄生虫可以重新编程细胞,使肝脏变大。研究结果表明,有可能利用
- 下一篇
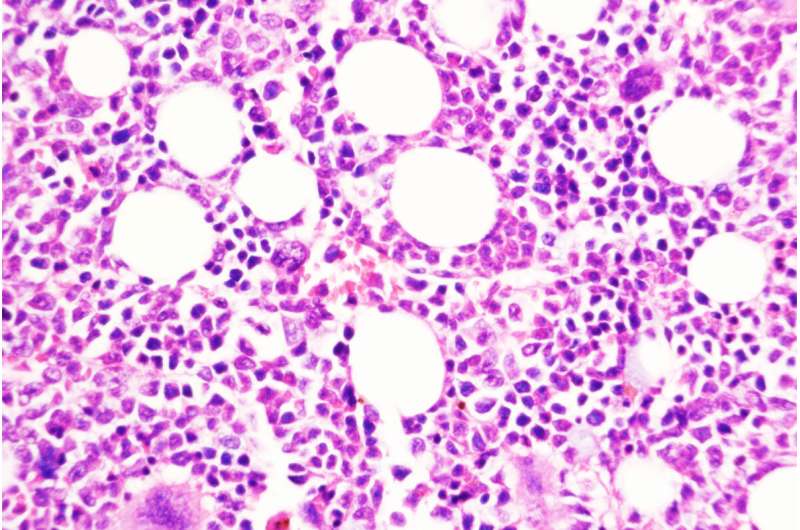
Nature子刊:慢性血癌转变为侵袭性疾病的关键
圣路易斯华盛顿大学医学院的一项研究提出了一种预防慢性、生长缓慢的血癌发展为侵袭性白血病的策略。图中显示的是用一种化合物阻断DUSP6的小鼠骨髓,DUSP6是由慢性疾病转变为侵袭性疾病的关键分子。一种慢性白血病可以潜伏多年。一些患者可能需要治疗来控制这种类型的血液癌症——骨髓增生性肿瘤(MPN),而另一些患者可能需要经过长时间的观

