类器官新进展!人鼠混合大脑类器官首次对视觉刺激做出反应!
随着干细胞技术的不断进步,源自人诱导多功能干细胞(human induced pluripotent stem cells, hiPSCs)的脑类器官已成为疾病模型中的热门话题。脑类器官有望为药物筛选、精准医学、神经修复等领域带来新的发展契机。
脑类器官的优势体现在下面两个方面:
-与二维细胞培养相比
脑类器官能体现出神经元组织的复杂特征,比如皮质层结构、细胞类型多样性等。
-与动物模型相比
脑器官能保留患者个体的遗传背景差异。此外,在小鼠皮层中植入的人脑类器官可以发生血管化,以此供应营养和氧气供应,防止类器官核中发生细胞坏死,并能将神经轴突延伸到周围的宿主组织中。
2022年10月16日,曾解读了斯坦福大学帕斯卡团队在Nature上发表的一篇重磅论文。该文以《Maturation and circuit integration of transplanted human cortical organoids》为题,报道了一种人鼠混合大脑类器官,为大脑神经退行性疾病研究和新药开发提供了新的策略。(文章回顾:Nature重磅:人鼠混合大脑问世,‘大脑类器官’研究再添新进展)


图片来源:Nature 610, 319–326 (2022)
然而,目前脑类器官的体内研究集中在少数细胞的局部和急性反应。移植的类器官如何接受外部刺激,并在受体中产生慢性功能反应,尚未得到证实。但现有的检测技术,无法支持同时在组织结构和电生理两个方面开展纵向研究。
为了回答上述问题,加州大学圣地亚哥分校Duygu Kuzum团队和波士顿大学Anna Devor团队开展合作。研究团队结合透明微电极阵列和双光子成像技术,对移植到成年小鼠脾后皮质(retrosplenial cortex)的人脑类器官进行纵向的多模态监测。2022年12月26日,相关成果以《Multimodal monitoring of human cortical organoids implanted in mice reveal functional connection with visual cortex》为题目,发表在Nature communications杂志上。


图片来源:Nat Commun 13, 7945 (2022)
类器官和微电极阵列共植入
可以对类器官移植物进行纵向监测
Duygu Kuzum团队和Anna Devor团队曾合作开发了一种透明的石墨烯微电极,实现了双光子显微镜、光遗传学刺激和皮层记录在体内的无串扰集成,相关成果于2018年发表在Nature communications杂志上。本文中,合作团队沿用了上述石墨烯微电极技术,以此来记录移植的脑类器官及周围宿主组织的电信号和光学信号。


微电极阵列结构示意图
图片来源:Nat Commun 9, 2035 (2018).
团队首先重组人体皮肤纤维细胞并获得hiPSCs。诱导hiPSCs产生脑类器官并培养7-9周后,根据尺寸和形状,挑选其中的单个脑类器官。团队选择8-12周龄的NOD/SCID小鼠为受体,将人脑类器官植入左脾后皮质(left retrosplenial cortex, RSC),然后将石墨烯微电极置于其上。团队还利用3D打印技术制作了一种帽子,用于保护电极上的线路。术后恢复一周后,每两周对小鼠进行电生理检测,整个实验持续8-11周。


类器官和微电极阵列共植入示意图
图片来源:Nat Commun 13, 7945 (2022)
类器官移植物对感觉刺激产生神经反应
研究团队首先通过施加视觉刺激,研究脑类器官能否对感官刺激产生功能性响应,并记录随之而来的电响应。团队提出假设,只有当类器官与宿主的视觉皮层组织整合后,才会开始对视觉刺激产生反应。
研究人员在实验小鼠的右眼前放置了一个光纤耦合的白光LED灯,该设备发出的光脉冲可以引发刺激诱导的电反应。之后在类器官以及接近视觉皮层的皮层通道中都清晰地检测到视觉刺激反应。从类器官植入3周后,一直到实验结束,研究人员在电极通道中确实观察到了局部场电位(local field potentials, LFP),说明类器官植入物与周围皮层组织建立突出连接,并接受小鼠大脑的功能输入。

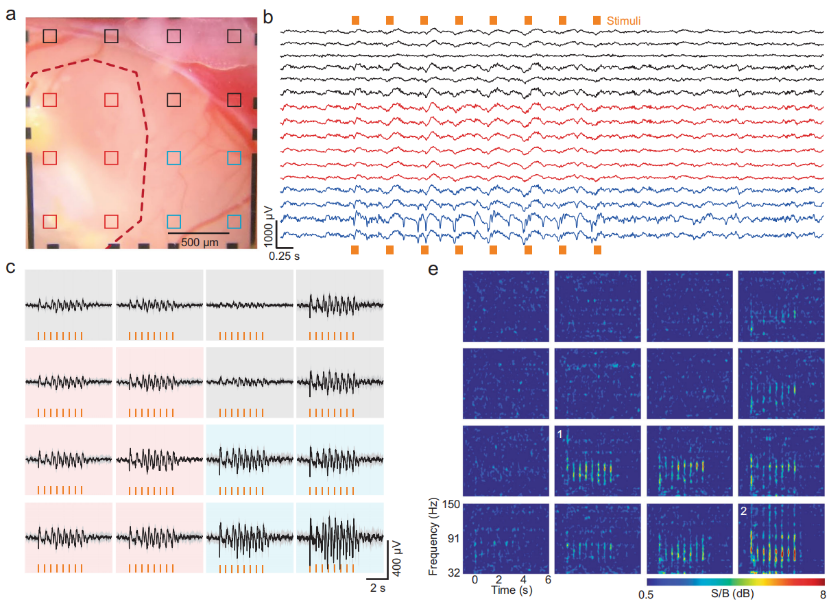
刺激诱发类器官和大脑皮层的局部场电位记录
图片来源:Nat Commun 13, 7945 (2022)
感觉刺激下
多单元活动发生调节
接着,团队研究了类器官的放电活动(spiking activity),是否受周围皮层神经活动调节。由于多单元活动(Multi-unit activity, MUA)可以反映局部神经元放电情况,研究人员在0.5–3 kHz带通滤波数据中对多单元活动进行评估。研究人员在脑类器官和小鼠大脑皮层中,分别选择了2个代表性的通道(类器官:O1和O4,小鼠:C2和C7)。在所有通道中,都观察到自发的多单元活动。而且当视觉刺激开始后,在类器官和小鼠大脑皮层中,都观察到多单元活动的增加。

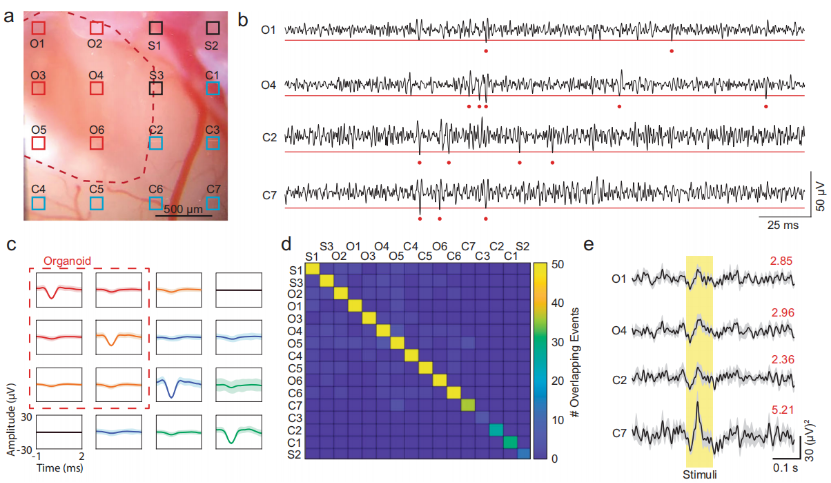
类器官和大脑皮层的多单元活动
图片来源:Nat Commun 13, 7945 (2022)
与宿主皮层相比
移植的类器官对麻醉的反应不同
研究人员进一步假设,类器官移植物主要接受局部信号输入,而像来自丘脑核和神经调节中心的长距离投射则不存在。由于麻醉已被证明会影响到大脑皮层的长距离投射活动,因此团队用1.5%异氟烷麻醉小鼠后,观察类器官与周围宿主皮层的自发神经活动的变化。
与周围皮质相比,异氟醚麻醉导致类器官神经元活性显著降低。而且在清醒状态下,类器官活性通常低于周围皮层,对特定频带也没有选择性。结果显示,类器官受局部神经元支配,但缺乏长程投射。

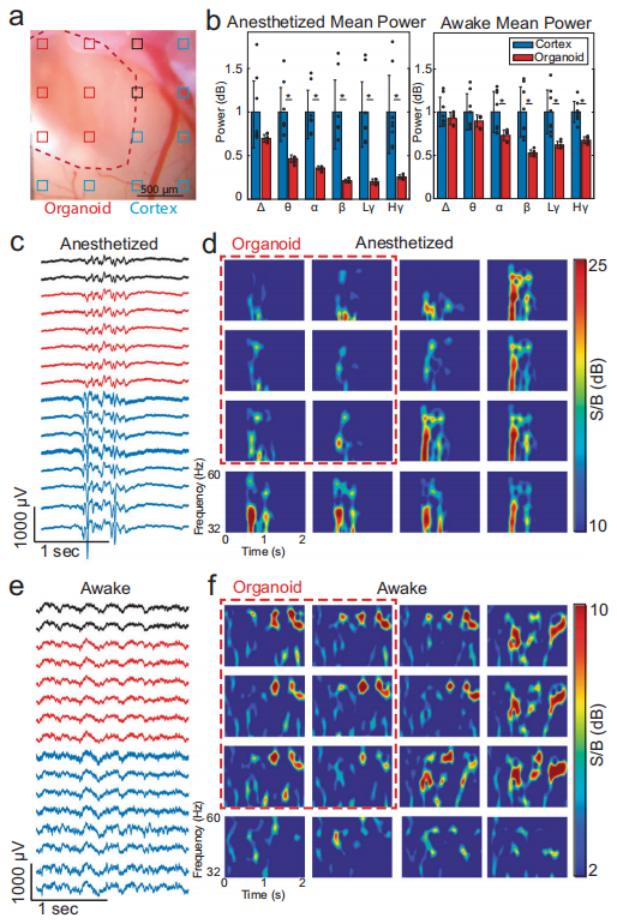
用1.5%异氟烷麻醉小鼠后,
分析类器官和小鼠大脑的局部场电位
图片来源:Nat Commun 13, 7945 (2022)
类器官移植物体内血管化
并与周围皮质整合
研究人员运用体内双光子成像和免疫染色技术,对类器官移植物与周围宿主组织的整合情况进行了观察。
血管化一直是类器官构建中的难点问题,在类器官植入的9到10周后,对小鼠注射血管内示踪剂Alexa Fluor 680葡聚糖。通过双光子显微镜,发现类器官植入区域都含有小鼠脉管系统。而且与周围皮质相比,类器官区域的血管密度较低。


类器官血管化的体内成像
图片来源:Nat Commun 13, 7945 (2022)
在类器官植入后的8到11周处死动物,并对大脑进行免疫组化染色,检测和分析人细胞(NM-95)、内皮细胞细胞(CD31)和神经元核(NeuN)。类器官植入区域显示NM-95阳性,说明植入细胞在整个实验周期中都存活了下来。而且,部分NM-95阳性细胞发生了细胞迁移。与双光子显微镜观察结果一致的是,研究人员也观察到了穿过类器官植入物的血管内皮细胞。通过NeuN和苏木精共染,发现类器官移植物有约48%的细胞具有神经元表型。


类器官血管化的免疫染色
图片来源:Nat Commun 13, 7945 (2022)
下一步的研究方向
本项研究中开发的实验装置,为研究发育性脑疾病背后的人类神经网络水平功能障碍提供了前所未有的机会。接下来,研究团队需要构建神经疾病模型,整合钙成像分析,并对类器官神经元的放电活动进行可视化。
Duygu Kuzum在接受采访时表示,未来干细胞技术一定会和神经记录技术结合,用于多个脑疾病研究场景。比如:在生理条件下构建疾病模型,基于患者来源类器官验证特定治疗方式,评估类器官修复特定丢失、退化或受损脑区的潜力。
虽然目前人脑类器官的功能过于原始,但随着人脑类器官移植相关研究的增加,类器官移植是否会影响动物脑功能或者动物行为值得关注。《猩球崛起4》的编剧,是不是可以考虑一下,融入当下这个热门话题?
参考资料:
1.Revah, O., Gore, F., Kelley, K.W. et al. Maturation and circuit integration of transplanted human cortical organoids. Nature 610, 319–326 (2022).
2.Wilson, M.N., Thunemann, M., Liu, X. et al. Multimodal monitoring of human cortical organoids implanted in mice reveal functional connection with visual cortex. Nat Commun 13, 7945 (2022).
3. Thunemann, M., Lu, Y., Liu, X. et al. Deep 2-photon imaging and artifact-free optogenetics through transparent graphene microelectrode arrays. Nat Commun 9, 2035 (2018).
4.https://medicalxpress.com/news/2022-12-human-brain-organoids-implanted-mouse.html

- 上一篇

首次证实,人脑类器官植入小鼠大脑后可建立功能连接,并对外部刺激做出反应
人的智慧,源于大脑。记忆、语言和情绪等复杂的生理现象均源自于大脑的一系列电生理活动,作为意识的载体,大脑让人类得以认知世界,并对外界的诸事诸物做出即时性的判断和反应。 毫无疑问,大脑是人体最复杂的器官。但直至现在,人类对自身大脑的行为模式的认知仍极为有限。 近日,美国加州大学圣地亚哥分校的研究人员在 Nature Communications 期刊发表了题为
- 下一篇
Nat Metabol:科学家揭示己糖激酶2在调节大脑小胶质细胞活性上所扮演的关键角色
近日,一篇发表在国际杂志Nature Metabolism上题为“Dual roles of hexokinase 2 in shaping microglial function by gating glycolytic flux and mitochondrial activity”的研究报告中,来自中国浙江大学等机构的科学家们通

