Nature子刊:专家解读ARIC研究,揭示CKD患者认知下降的秘密
2022年12月2日,来自美国的科学家在Nature Review of Nephrology上公布了社区
ARIC研究的最新事后分析结果
Scheppach等多国专家事后分析了ARIC研究数据1,数据包括参与者的肾功能指标与脑部磁共振成像(MRI)结果。该分析旨在探究CKD患者认知下降的原因与风险因素。共计1527例患者入组该分析,肾功能指标包括了尿
研究发现,eGFR每降低1个四分位距(IQR)则患者的脑皮质体积减小(回归系数:-0.07;95% CI,-0.12~-0.02)、脑白质增多(回归系数:0.07;95% CI,0.01~0.15),而脑白质的各向异性分数降低(回归系数:-0.08;95% CI,-0.17~-0.01)。当研究人员采用胱抑素C、肌酐、肌酐+胱抑素C/B2M的不同方程计算eGFR时,均得出相似结果。
较高的log UACR与
进一步研究发现,CKD4期患者,特别是eGFR(基于胱抑素C,且使用CKD-EPI公式)<30ml/min/1.73㎡和UACR水平较高的患者,脑白质体积增加和脑萎缩的风险较高。更重要的是,脑萎缩
越辩越明,专家解读²
01.回顾既往,综合评价
既往研究显示,eGFR水平与神经退行性疾病缺乏相关性,这与本报告一致。一项对50例接受长期血液透析的患者尸检研究发现,无阿尔茨海默病的病理改变证据。另一项对CKD死者的大脑神经病理学研究发现,小动脉硬化的患病率(73%)较高,并且依然未发现阿尔茨海默病的病理改变证据。在“90+研究”中,对166例平均年龄为93岁的社区参与者研究后发现,基于胱抑素C计算的eGFR水平与β-淀粉样蛋白之间无关联。
最近,关于肾-脑轴的一系列研究发现,基于胱抑素C计算的eGFR优于肌酐。与肌酐不同,胱抑素C受蛋白质、肌肉量和年龄的影响较小。由于
Scheppach等的研究显示,白蛋白尿或UACR可能是比eGFR更敏感的,全身性血管损伤生物标志物。此种认识也有既往研究支持。REG
02.上下求索,寻因病理机制
那么,为什么CKD可以导致微血管损伤呢?
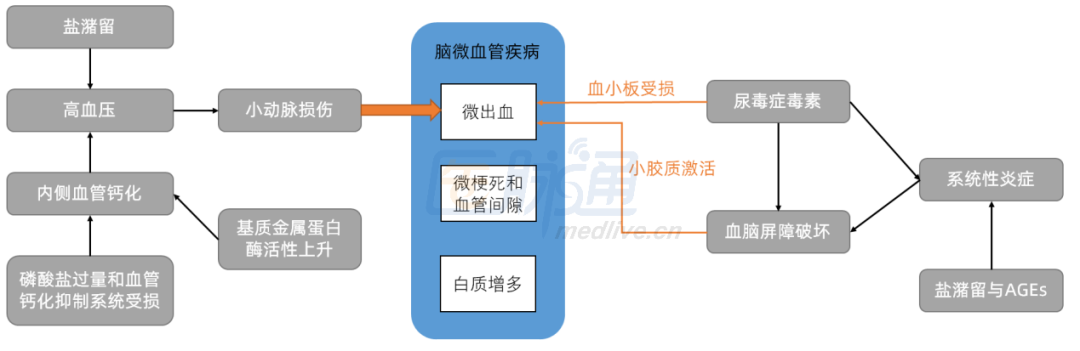
图1 CKD导致脑微血管疾病的病理机制
备注:AGEs为晚期糖基化终产物;小胶质包括尿毒症毒素、内毒素和尿素
03.防患未然,关注风险人群
确定CKD认知障碍的高风险人群是有利于临床管理的。目前,长期透析患者已被认为是认知障碍的高风险人群,然而,并不清楚早期CKD患者是否具有类似风险。Scheppach等认为基于胱抑素C的eGFR<30ml/min/1.73㎡的CKD患者,其认知障碍的发生风险较高,但其他既往研究则认为处于更高eGFR水平的CKD患者也有较高的认知障碍发生风险。
总之,越来越多的证据表明,CKD是脑部微血管病的风险因素,而脑部微血管病是CKD患者认知功能障碍的独立危险因素。基于现有证据,钠
参考文献:
1. Scheppach JB, Wu A, Gottesman RF, et al. Association of Kidney Function Measures With Signs of Neurodegeneration and Small Vessel Disease on Brain Magnetic Resonance Imaging: The
2. Lau WL, Fisher M. New insights into cognitive decline in chronic kidney disease. Nat Rev Nephrol. 2022 Dec 2.
- 上一篇

一表总结,CKD患者营养治疗最新进展
既往研究表明,低蛋白饮食(LPD)可以延缓慢性肾脏病(CKD)患者的肾病进展。目前有三种代表性的LPD食谱,它们分别为蛋奶素食、纯素食以及杂食。然而,这三种食谱各有利弊,并且既往研究的结果并不一致。因此,对于CKD患者而言,究竟哪种食谱更加安全,同时,是否需要补充膳食补剂,以避免营养不良呢? 2022年11月29日,美国专家在Journal of Renal
- 下一篇
2030年DKD治疗有何变化?抗炎治疗或成为重中之重
糖尿病肾病(DKD)在我国的发病率呈上升趋势,已成为终末期肾脏病(ESRD)的第二位病因,仅次于各种肾小球肾炎。值得注意的是,由于DKD患者存在各种复杂的代谢紊乱,一旦发展至ESRD时期,则可能比其他肾脏疾病更为棘手。然而,最近一系列研究发现,DKD以及糖尿病合并慢性肾脏病(CKD)不仅仅是因为代谢异常所致,还与炎症密切相关。2022年12月2日,Kidne

