2030年DKD治疗有何变化?抗炎治疗或成为重中之重
糖尿病
2022年12月2日,Kidney International 发布了一项综述。该综述在结合现有临床证据后发现,导致DKD的病因不仅与高血糖、晚期糖基化终末产物(AGE)等代谢异常相关,也与炎症密切相关。专家们认为,抗炎药物将在未来DKD的管理中扮演重要角色,甚至预测在2030年,DKD的治疗重点将是抗炎治疗。本文回顾了DKD的病因与机制、现行治疗方案以及潜在DKD抗炎药物。
一、DKD的病因与机制
许多临床和临床前研究证据都表明,炎症在DKD的发生和发展中起到一定作用。代谢异常(如高血糖、AGE等)、次级介质的损伤(如血管紧张素II和醛固酮)以及肾细胞损伤或功能障碍会产生各种病理后果(如蛋白尿、Klotho生成减少、脂质蓄积),上述异常会激活免疫细胞,从而导致肾脏炎症。此外,这些异常还会使免疫细胞,如中性粒细胞、巨噬细胞、树突细胞、T和B淋巴细胞等富集于肾脏,并参与了糖尿病
临床前研究发现,长期的代谢异常会导致表观遗传机制异常,例如激活NF-κB、toll样受体(TLRs)和造成氧化应激(NrF2)。在既往临床研究中,发现DKD患者以及糖尿病患者的相关促炎因子被激活,如肿瘤TNF-α。部分DKD患者的肾
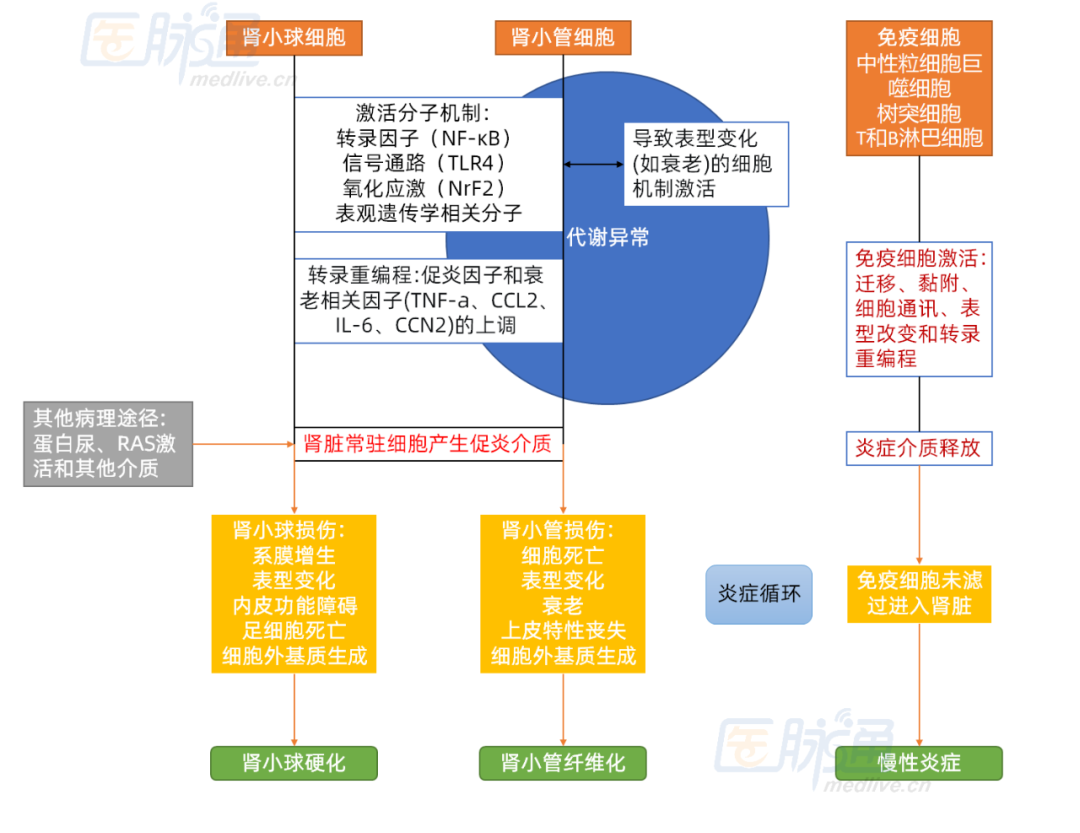
图1 糖尿病肾损伤的机制
备注:RAS为肾素-血管紧张素-醛固酮系统
二、现行治疗方案
目前,DKD的治疗手段包括RAS阻断剂、醛固酮受体拮抗剂(MRA)和钠
三、潜在DKD抗炎药物
目前,共有18种潜在DKD抗炎药物正处于临床研究阶段,但由于疗效或决策不佳,部分药物已停止研发。本文仅讨论6种药物/治疗方案,其中包括了细胞疗法。
1.Nrf2活化剂
核转录因子,Nrf2是诱导抗氧化反应的主要调节因子,也可通过两种机制发挥抗炎作用的物质。它可抑制NF-κB和LRR和PYD结构域蛋白3(NLRP3)炎性小体。在一项2期临床研究中发现,Nrf2活化剂,甲基巴多索隆可以提高DKD患者的估算肾小球滤过率(eGFR),但容量超负荷、
既往研究发现,日本DKD患者的心血管疾病发生风险低于西方国家,这或许是甲基巴多索隆在日本DKD患者中表现较好的原因。在TSUB
2.
内皮素-1(ET-1),是一种有效的血管收缩肽,可以与ETA和ETB,两种不同的受体结合。ETA具有促进血管收缩、炎症、纤维化和细胞增殖的作用,而ETB是其生理拮抗受体。ET-1可以激活免疫细胞(中性粒细胞)、内皮细胞和系膜细胞,激活NF-κB通路,上调黏附因子和细胞因子的基因转录。在临床前研究发现,内皮素受体拮抗剂可以降低小鼠的肾损伤和巨噬细胞浸润,并降低炎症生物标志物。
3期临床研究,SONAR研究发现,阿曲生坦减少了
3.可溶性鸟苷酸环化酶激活剂
CKD和DKD的氧化应激与一氧化氮(NO)、环鸟苷酸(cGMP)的生成和可溶性鸟苷酸环化酶(sGC)信号通路降低相关。sGC激活剂可增加sGC对NO的敏感性,增加cGMP的产生,从而增强DKD患者体内的NO-sGC-cGMP信号,以达到减轻肾脏炎症和纤维化的目的。虽然,在临床前研究中,sGC激活剂疗效较好,但在临床研究中,sGC激活剂并不能降低CKD伴2型糖尿病患者的蛋白尿。
4.靶向细胞因子
大量既往研究表明,炎症细胞因子与DKD密切相关,因此抑制炎症因子的产生与释放可能保护患者肾脏功能。目前,并未有针对CKD或DKD患者,抑制炎症细胞因子的临床研究。但在自身免疫性疾病中,CCX140-B可以减少蛋白尿,同时,Baricitinib也可以减少蛋白尿和炎症生物标志物(CXCL10、CCL2、TNF-R1/2)的水平。
5.细胞凋亡信号调节激酶1
细胞凋亡信号调节激酶1(ASK1)和NF-κB诱导激酶(NIK)在炎症和肾脏疾病中有强有力的证据。Selonertib是一种ASK1抑制剂,已进入DKD2期临床开发阶段。在1期临床研究中,ASK1并未改善患者的eGFR,但在2期临床研究中,Selonertib组和安慰剂组的eGFR斜率分别为-2.29(0.58)和-3.49(0.58)ml/min/1.73㎡(P = 0.14)。目前,并未有3期临床研究的相关信息。
6.细胞疗法
间充质干细胞可在多种情况下调节炎症,包括DKD。目前,只有一些早期临床研究表明,注射同种异体的间充质干细胞在2型糖尿病以及DKD患者中是安全的,但疗效还需要更多研究。
总的来说,抗炎应在DKD治疗中占有一席之地。或许,在2030年,抗炎治疗将成为DKD以及CKD伴2型糖尿病的重要疗法。现在,除了研究抗炎药物外,还应该提高检测手段,明确何种细胞介质在DKD炎症反应中起主导作用,进而采用个体化的抗炎治疗方法。
参考文献:
1. 王宓,左力.糖尿病肾病诊治专家共识解读[J].临床内科杂志,2020,37(09):675-678
2. Rayego-Mateos S, Rodrigues-Diez R, Fernandez-Fernandez B, et al. Targeting inflammation to treat diabetic kidney disease: the road to 2030. Kidney Int. 2022 Dec 2:S0085-2538(22)01017-1.
- 上一篇
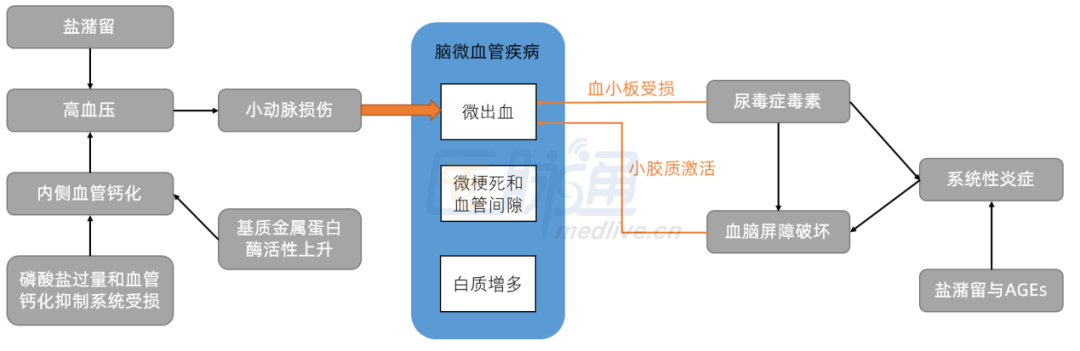
Nature子刊:专家解读ARIC研究,揭示CKD患者认知下降的秘密
慢性肾脏病(CKD)是认知功能下降的危险因素,多项流行病学调查显示,随着CKD病程进展,患者的认知功能下降风险越高。这一发现引发了学者们更多的思考。比如,认知功能下降是与CKD共病(如高血压、高血糖)相关,还是反应了肾-脑联系?CKD是诱导了脑部神经性变性还是血管性变性?只有确认了CKD患者认知下降的机制,才可能有效预防、干预CKD患者的认知下降。2022年
- 下一篇
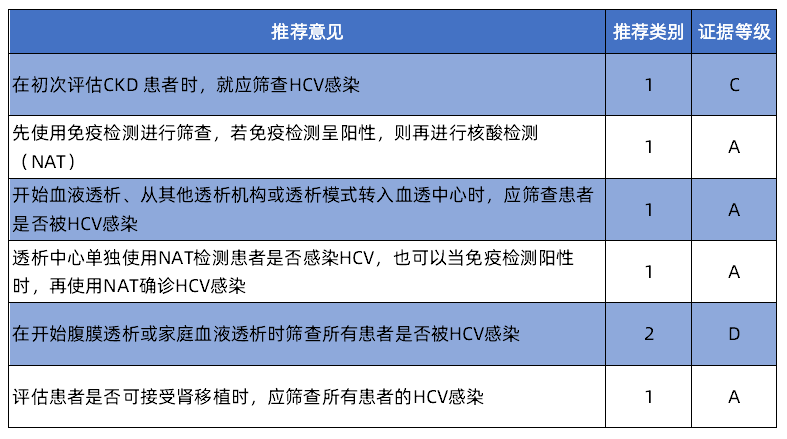
KDIGO最新指南发布,更新CKD患者的丙肝管理!
由于慢性肾脏病(CKD)患者的肾功能不全,其身体状况与健康人群有一定差异。与普通人群相比,丙肝病毒(HCV)感染在CKD患者中更为普遍。HCV不仅对患者的肝功能产生影响,还是透析患者存活率较低和肾移植后存活率较低的独立危险因素。因此,如何管理HCV感染的同时不影响CKD患者的肾脏疾病治疗,成为肾内科医生尤为关心的问题。时隔4年,KDIGO发布对2018版指南

