CDD:浙江大学白雪莉/梁廷波发现靶向泛素特异性蛋白酶8使胰腺癌的抗程序性死亡配体1免疫疗法敏感
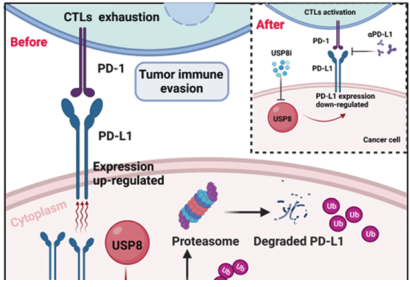
程序性死亡受体1(PD-1)及其配体程序性死亡配体1 (PD-L1)帮助肿瘤细胞逃避免疫监测,被认为是抗肿瘤免疫治疗的重要靶点。PD-L1翻译后修饰在免疫抑制方面具有潜在价值。
2022年12月20日,浙江大学白雪莉及梁廷波共同通讯在Cell Death & Differentiation(IF=12)在线发表题为“Targeting ubiquitin-specific protease 8 sensitizes anti-programmed death-ligand 1 immunotherapy of pancreatic cancer”的研究论文,该研究表明靶向泛素特异性蛋白酶8能够使胰腺癌的抗程序性死亡配体1免疫疗法敏感。该研究发现泛素特异性蛋白酶8 (USP8)去泛素化PD-L1。胰腺癌组织中USP8水平明显高于正常组织。临床上,USP8的表达在多个胰腺癌患者来源的队列中显示出与肿瘤-淋巴结转移阶段的显著相关性。同时,USP8缺失可以免疫依赖性地减少肿瘤侵袭迁移和肿瘤大小,提高抗肿瘤免疫原性。
USP8抑制剂预处理减少了肿瘤发生,USP8敲除肿瘤的免疫功能正常小鼠表现出延长的生存期。此外,USP8与PD-L1正向相互作用,并通过抑制胰腺癌中泛素化调控的蛋白酶体降解途径上调其表达。USP8抑制剂和抗PD-L1联合治疗通过激活细胞毒性T细胞有效抑制胰腺肿瘤生长,抗肿瘤免疫主要依赖于PD-L1途径和CD8 + T细胞。总之,该研究结果强调了靶向USP8的重要性,它可以使PD-L1靶向的胰腺癌对免疫治疗敏感,并可能代表未来治疗胰腺肿瘤患者的一种新的治疗策略。

- 上一篇

Advanced Science | 天津医科大学郝继辉等团队合作发现CD73通过非核苷酸酶依赖性机制促进胰腺癌的转移
CD73是一种细胞表面结合的核苷酸酶,通过将5′-AMP水解为腺苷来促进细胞外腺苷的形成。研究表明,CD73在免疫逃逸、细胞增殖和肿瘤血管生成中起着重要作用,成为癌症治疗的潜在靶标。然而,CD73酶抑制剂的临床应用效果不佳,表明其在肿瘤进展中的作用机制比预期更复杂,需进一步研究。 2022年12月23日,天津医科大学郝继辉、Chang Antao
- 下一篇
NEJM:KRAS抑制剂sotorasib治疗胰腺癌安全有效(CodeBreaK100研究)
胰腺癌被人们称作“癌王”,因其超高的治疗难度以及恶性程度而令人闻风丧胆。美国国家癌症院的统计数据中,晚期胰腺癌患者的五年生存率,仅有2.9%,为常见癌症中最低。 90%-93%的胰腺癌患者会出现KRAS突变。KRAS是一种小GTP酶,通常在上游受体酪氨酸激酶(如EGFR(表皮生长因子受体)和相关家族成员ERBB2(HER2)、ERBB

