Nature:一个基因让胰腺癌“改邪归正”!
美国胰腺癌患者的5年生存率是11%,是名副其实的癌王。
近日,Behrens团队在顶级期刊《自然》发表重要研究成果,GREM1的蛋白对胰腺癌的发生和发展极为重要。如果GREM1失活,胰腺上皮细胞在几天之内就能变成胰腺癌细胞(间质化);而GREM1在癌细胞中过表达的话,癌细胞竟然几乎全部都“上皮化”了,出现了间质上皮化的过程,胰腺癌它可能就变成一个恶性程度低的囊肿!

论文首页截图
GREM1基因编码gremlin 1蛋白, 它是一种DAN family BMP antagonist,它的表达会抑制成骨形成。此前研究也发现GREM1表达与ER阴性的乳腺癌、肺癌等肿瘤的预后相关。来自癌症和非癌组织微阵列的数据表明,grem1 和其他 BMP 拮抗剂对癌症基质的存活和某些癌症的增殖很重要。 Gremlin1 是一种高保守型分泌蛋白,通过与BMP-2、BMP-4 以及 BMP-7 特异性结合的方式,抑制BMP配体与相应受体结合,参与调控胚胎时期骨组织、肾脏等重要器官发育。在20世纪初西方社会的传说中,Gremlins 是一群四处调皮捣蛋的“小恶魔”,而在生物世界中,研究人员发现,Gremlin1 也像群小恶魔一样通过拮抗 BMP 信号通路参与了多种肿瘤的恶性进展,比如脑胶质瘤,结直肠癌,肺癌等。Grem1 表达存在于许多癌症中,被认为在子宫颈癌、肺癌、卵巢癌、肾癌、乳腺癌、结肠癌、胰腺癌和肉瘤癌中起重要作用。 更具体地说,Grem1 结合位点(在残基 1 至 67 之间)与结合蛋白 YWHAH(其与 Grem1 的结合位点在残基 61-80 之间)相互作用,被视为针对人类癌症的潜在治疗和诊断靶点。Grem1 还在人肺组织内皮的血管生成中发挥 BMP 依赖性作用,这意味着 Grem1 在癌症发展中的作用。
在上个月,上海瑞金医院团队还发现它与前列腺癌间的密切关系。研究结果发表在Nature Cancer 上,该研究揭示了分泌蛋白 Gremlin1 作为 FGFR1 的新型配体,通过 FGFR1/MAPK 信号通路调控肿瘤细胞可塑性、促进去势抵抗性前列腺癌(CRPC)发生发展以及 Gremlin1 特异性抗体的应用治疗研究。

但是与胰腺癌间的关键性作用,以往研究还相对较少。
Behrens团队基于胰腺导管腺癌(PDACs,占全部胰腺癌的90%左右)小鼠模型研究,以及对人类癌症基因组图谱(TCGA)数据库的分析,发现了GREM1与胰腺导管腺癌的发生发展存在一定关系。
为了了解GREM1对胰腺导管腺癌进展的影响,研究人员先敲除了特定胰腺导管腺癌模式小鼠的Grem1基因。Grem1基因被敲除的模式小鼠中,90%发生了胰腺癌肝转移,而Grem1基因正常表达的模式下,只有15%小鼠发生了胰腺癌肝转移。如果比较肝转移灶的话,也是Grem1基因被敲除的模式小鼠更多。说明Grem1基因具有显著抑制胰腺癌肝转移的作用。
进一步,从组织学上看,Grem1基因被敲除模式小鼠的肝转移灶分化程度较低,而Grem1基因正常模式小鼠的肝转移灶分化程度高。团队还分析了原发性和转移性人胰腺导管腺癌队列的数据,发现Grem1基因的表达在转移灶中明显减少。这些数据表明,Grem1基因失活会导致胰腺导管腺癌的恶性程度和转移性增加。
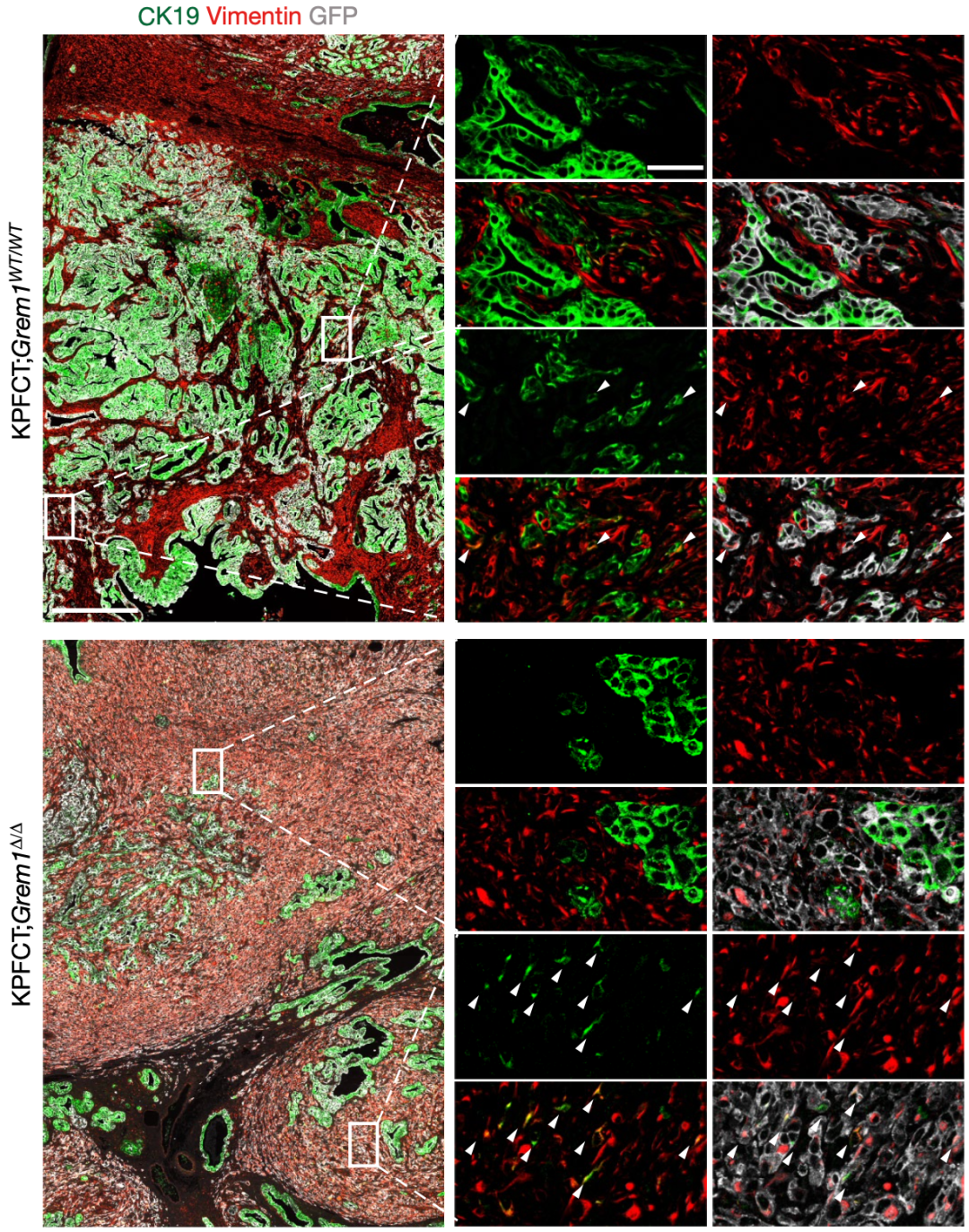
Grem1基因缺失对胰腺导管腺癌发展的影响
为了进一步验证GREM1蛋白的功能,Behrens团队在胰腺导管腺癌类器官中过表达Grem1基因,然后再将这些类器官移植到小鼠身上,结果发现那些类器官变成了分化良好的囊性肿瘤,恶性肿瘤细胞数量显著减少。类器官是一种在体外比较接近体内的真实的器官环境的研究方案,具有较高的参考价值。
同时,在人类的胰腺导管腺癌细胞系中过表达Grem1基因后,也观察到上皮标志物表达水平增加,这意味着这个机制在人类中可能也是存在的。而上皮质间质化(EMT),一般认为是良性组织向恶性肿瘤转化的关键机制。
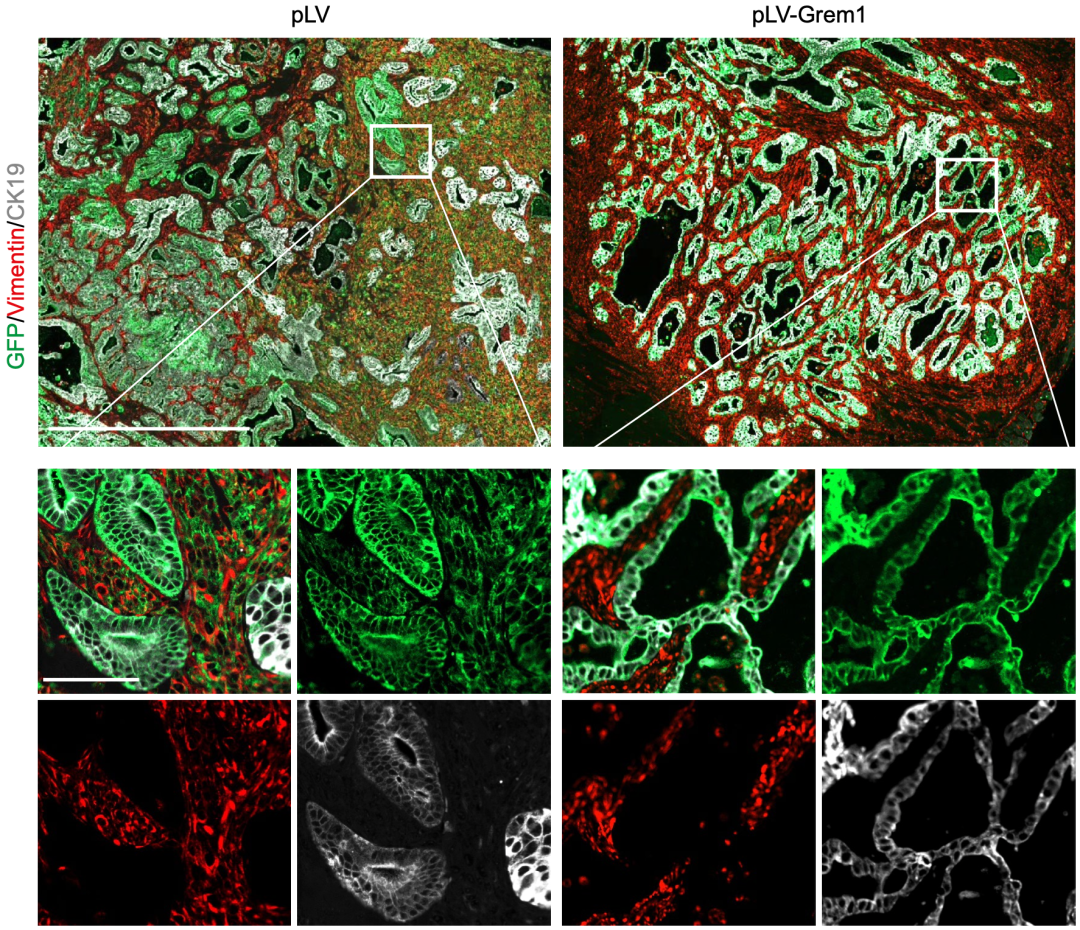
Grem1基因过表达对胰腺导管腺癌发展的影响
为了进一步明确机制,Grem1 在间充质 PDAC 细胞中高表达,并抑制上皮细胞区室中上皮间充质转化转录因子 Snai1(也称为 Snail)和 Snai2(也称为 Slug)的表达,因此限制了上皮间充质可塑性。 团队研究发现GREM1蛋白通过调节骨形态发生蛋白(BMPs),影响胰腺导管腺癌的进展,而BMP2反过来又可以调控GREM1蛋白的水平,构成一个自我抑制反馈回路。以前认为GREM1能抑制BMP2,但是这次还发现BMP2也会反馈性调控GREM1。因此,持续抑制 BMP 活性对于维持上皮 PDAC 细胞至关重要,这表明维持胰腺癌的细胞异质性需要由单一可溶性因子引发的连续旁分泌信号传导。
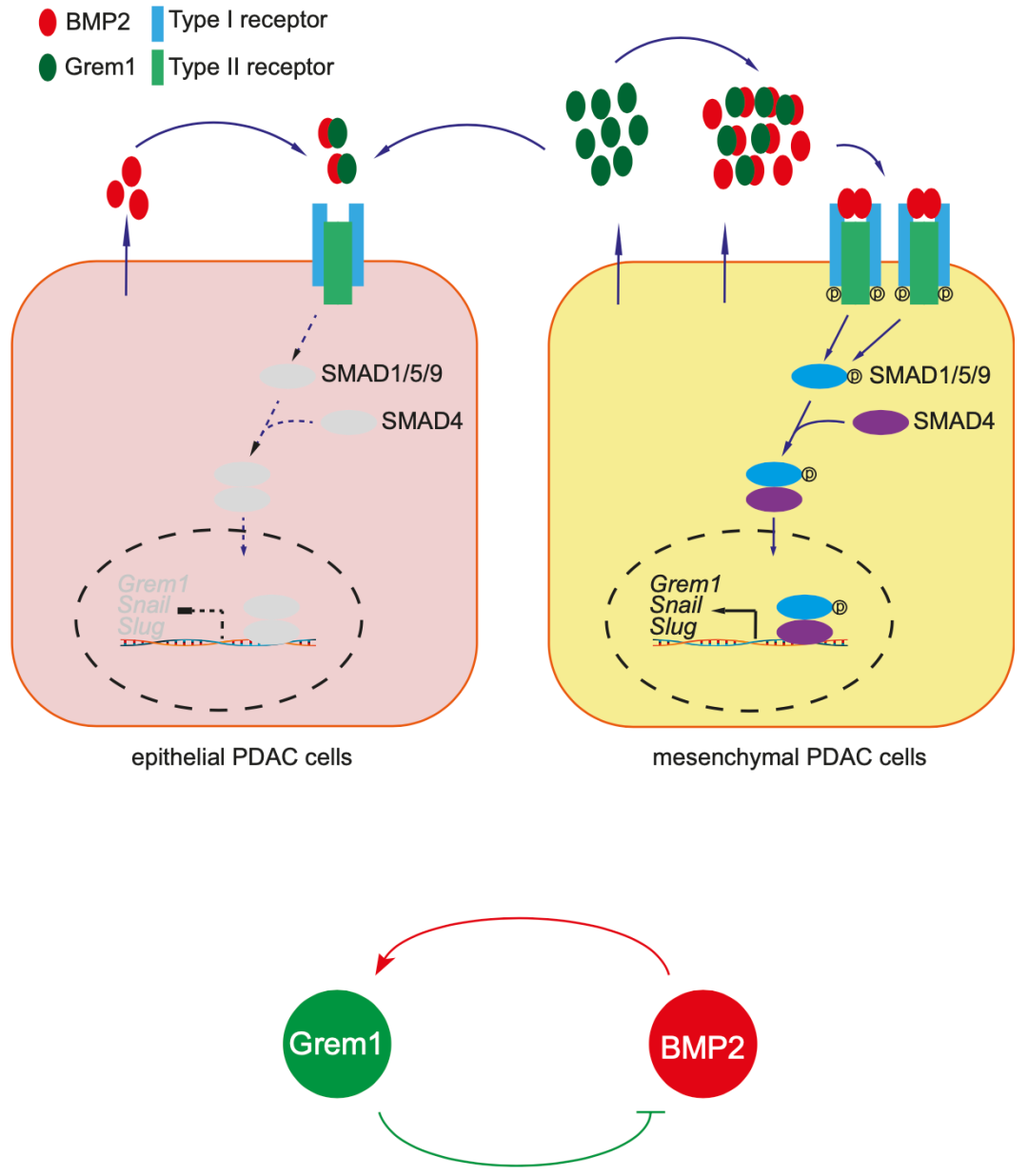
机制示意图
这一研究进展非常重磅,为胰腺癌的治疗开辟了一条新的路子。Behrens也认为,他们在实验室里完成的这项研究表明,我们有可能逆转胰腺癌的细胞命运,让时间在这种高度侵袭性肿瘤出现“倒流”,让它回到更容易治疗的状态。
最近Cancer Discovery发表最新一篇短文针对这篇文章给出述评,进行了较高的评价。
英国癌症研究所的首席负责人Kristian Helin 教授说:“这一新发现拓宽了我们对胰腺癌如何获得在全身生长和扩散能力的分子基础的理解。 尽管需要做更多的工作,但这类基础研究对于开发新的更有效的癌症治疗方法至关重要。”
当然,梅斯仍然要说的是,胰腺癌作为癌王,可能不是一个biomarker或基因就能完全解决的。这项研究主要基于动物研究的结果,至于到人体,GREM1是否仍然有作用,这仍然是巨大的疑问。而且GREM1基因表达的蛋白为gremlin 1,它作为一种分泌蛋白,可能具有广泛的作用,未必能成为一个“好”靶点。但是,通过调控BMP通路,有可能成为肿瘤治疗的一项备选思路。
同时,这项研究还给人们一个启示,对待肿瘤细胞,是否一定要杀灭?还是通过一定的手段,将肿瘤组织由间质向上皮逆转化,让它“逆转”为良性细胞,或维持稳定,带瘤生存,都可能是未来的重要选项。GREM1虽然不具备杀死胰腺癌细胞的能力,却能让其正常化,这个思路应该具有广泛的启示意义。
参考文献:
Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72(1):7-33. doi:10.3322/caac.21708
GREM1 is associated with metastasis and predicts poor prognosis in ER-negative breast cancer patients. https://biosignaling.biomedcentral.com/articles/10.1186/s12964-019-0467-7
Lan L, Evan T, Li H, et al. GREM1 is required to maintain cellular heterogeneity in pancreatic cancer. Nature. 2022;607(7917):163-168. doi:10.1038/s41586-022-04888-7
GREM1 Restricts Plasticity and Maintains Heterogeneity in Pancreatic Cancer. Cancer Discov. 2022 Jul 8:OF1. doi: 10.1158/2159-8290.CD-RW2022-0124
Park W, Chawla A, O'Reilly EM. Pancreatic Cancer: A Review. JAMA. 2021;326(9):851-862. doi:10.1001/jama.2021.13027
https://www.icr.ac.uk/news-archive/scientists-discover-mechanism-controlling-spread-of-pancreatic-cancer
Gremlin1 is a therapeutically targetable FGFR1 ligand that regulates lineage plasticity and castration resistance in prostate cancer. https://www.nature.com/articles/s43018-022-00380-3
《自然》重磅:把“癌王”逆转成囊肿?!科学家可能找到了关键的钥匙 https://mp.weixin.qq.com/s/VUto087Rlg14iGLY4p93ig
- 上一篇

Nature子刊:浙大易文/周如鸿合作揭示糖基化调控胰腺癌新机制
胰腺癌是一种恶性程度极高的消化系统肿瘤,确诊后患者的五年生存率仅为10%左右。代谢的改变是肿瘤细胞的重要特征之一。肿瘤细胞通过代谢重编程产生其快速增殖所需的物质、能量以及氧化还原力。癌基因Kras突变的胰腺导管腺癌(PDAC,胰腺癌中最常见的病理类型)的增殖高度依赖谷氨酰胺(Gln)分解代谢途径。在该途径中,Gln首先被转化成天冬氨酸(Asp),随后在谷草转
- 下一篇

Radiology:CT和CA19-9对非转移性胰腺癌治疗效果的评估
众所周知,准确评估治疗反应对于癌症患者的管理非常重要。目前对大多数类型的肿瘤进行反应评估的标准方法是实体瘤反应评估标准(RECIST)1.1版,包括四个类别:完全缓解、部分反应(PR)、疾病稳定(SD)和疾病进展(PD)。然而,RECIST并不总是作为患者生存的替代标记物的最佳选择。 关于胰腺导管腺癌(PDAC),CT一直是治疗反应评估的主要依据。然而许多作

