重磅级文章解读:科学家们在肝癌研究领域取得的新成果!
有研究指出,肝癌在46个国家中是癌症死亡的三大原因之一,且新发病例和相关死亡率预计未来将会急剧上升;到2040年,预计将有140万人被诊断为肝癌,肝癌新病例数较2020年将增加55%;到2040年,将有130万人死于肝癌,肝癌死亡率较2020年也会增加56.4%。
近年来,科学家们在人类肝癌研究领域进行了大量研究,也取得了大量重要的研究成果,本文中,小编就对相关研究进行整理,分享给大家!
【1】Science子刊:衰老的肝星状细胞触发肥胖相关肝癌机制
doi:10.1126/sciimmunol.abl7209
在点一份额外的炸薯条之前,需要再考虑一下了。它可能会导致患肝癌的风险增加。作为一种也可能导致肝癌的脂肪性肝病,非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的病例在增加,然而有效的治疗方法仍然难以找到。
在一项新的研究中,来自日本大阪公立大学和东京理科大学等研究机构的研究人员向抑制和治疗NASH相关的肝癌迈出了潜在的一步,他们利用肥胖小鼠的研究解释了肿瘤微环境中癌细胞附近的细胞膜孔所分泌的蛋白对肝癌产生的重要性,相关研究结果发表在Science Immunology期刊上,论文标题为“Gasdermin D–mediated release of IL-33 from senescent hepatic stellate cells promotes obesity-associated hepatocellular carcinoma”。
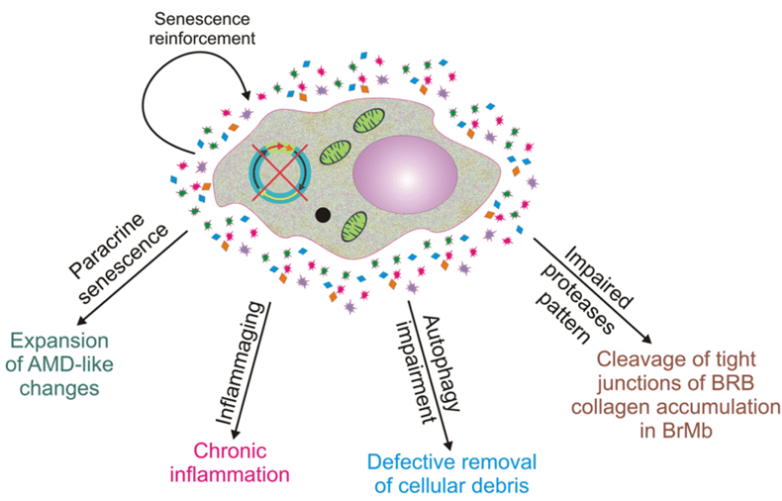
图片来源:Cellular and Molecular Life Sciences, 2020, doi:10.1007/s00018-019-03420-x。
虽然癌细胞本身显然是有害的,但邻近的细胞,包括所谓的“肿瘤微环境”中与癌症相关的成纤维细胞,也会在癌症产生中起到一定作用。论文通讯作者Naoko Ohtani教授解释说,“在肥胖相关的肝脏肿瘤微环境中,称为‘肝星状细胞(hepatic stellate cell)’的成纤维细胞变得衰老。”这导致它们表现出衰老相关的分泌表型(SASP),在这种表型中,它们释放出一系列通过抑制抗肿瘤免疫力来促进癌症的蛋白。SASP因子等蛋白被释放出来并加速肿瘤产生的机制仍不清楚。
Ohtani教授及其团队试图通过给易患癌症的小鼠喂食高脂肪饮食并研究肥胖引起的肝癌来揭开这一机制。他们首先进行了全面的基因表达分析,以确定哪些SASP因子是由肝星状细胞产生的,然后研究它们是如何被释放出来的;SASP因子IL-1β和IL-33被发现是肝癌生长的两个关键促进因子。它们的释放主要发生在两个阶段。Ohtani教授阐述说,“首先,高脂肪饮食削弱了肠道屏障功能,导致脂磷壁酸(lipoteichoic acid)在肝脏中迁移和积累。第二,积累的脂磷壁酸刺激了galdermin D蛋白的裂解。这反过来又形成了细胞膜孔,肝星状细胞通过这些细胞膜孔将IL-1β和IL-33输出或释放。”
【2】Hepatology:肿瘤坏死因子-α诱导炎性微环境促进肝癌的发生
doi:10.1002/hep.32738
肝细胞癌仍然是全球癌症相关死亡的重要原因。肝细胞癌相对隐匿性较强,一般诊断为晚期,预后较差。此外,肝细胞癌的异质性降低了靶向治疗的有效性。这些事实促使我们把重点放在预防肝癌上。然而,目前对肝癌发生的机制尚不完全清楚,这极大地限制了肝癌的预防。
越来越多的证据表明,间充质干细胞(MSCs)是肝脏受损局部组织和肿瘤微环境的家园。慢性炎症被认为是原发性肝癌的主要特征。然而,内源性MSCs在炎症环境中的特征及其在肝癌发生中的作用尚不清楚。
近日,来自第二军医大学附属第三医院的研究者们在Hepatology杂志上发表了题为“AIF1 + CSF1R + MSCs, induced by TNF-α, act to generate an inflammatory microenvironment and promote hepatocarcinogenesis”的文章,该研究结果表明,动员到损伤部位的MSCs可以被巨噬细胞培养。反过来,受过刺激的MSCs参与了慢性炎症微环境的产生和促进肝癌的发生。
在本研究中,研究者采用单细胞RNA测序的方法,鉴定了肝癌发生前存在于微环境中的一个非炎症相关的MSCs亚群,即AIF1+CSF1R+MSCs。进一步,研究者发现这一MSCs亚群很可能是由肿瘤坏死因子-α刺激通过TNFR1SIRT1途径诱导的。在大鼠原发性肝癌模型中,研究者发现高表达SIRT1的MSCs(Ad-Sirt1-MSCs)促进巨噬细胞募集,并通过分泌CCL5协同促进肝癌的发生。有趣的是,Ad-Sirt1-MSCs中巨噬细胞的耗尽或CCL5表达的下调减弱了Ad-Sirt1-MSCs对肝脏炎症和肝癌发生的促进作用。最后,研究者证明SIRT1通过激活AKT/HIF1α信号轴上调MSC中CCL5的表达。
【3】JAMA Netw Open:警惕!携带特定基因突变、且肥胖及过度饮酒会让个体患肝癌的风险增加近30倍!
doi:10.1001/jamanetworkopen.2022.34221
众所周知,过度饮酒和肥胖会增加机体患肝硬化和肝癌的风险,但拥有这些因素的个体患病的风险却并不相同。近日,一篇发表在国际杂志JAMA Network Open上题为“Synergistic Associations of PNPLA3 I148M Variant, Alcohol Intake, and Obesity With Risk of Cirrhosis, Hepatocellular Carcinoma, and Mortality”的研究报告中,来自贝勒医学院等机构的科学家们通过研究发现,当结合饮酒和肥胖一起考虑时,名为PNPLA3的关键遗传突变风险因素或许在增加机体肝硬化、肝癌和肝脏相关死亡的风险上发挥着一定的协同作用。
文章中,研究人员对来自英国生物样本库中40多万名个体进行了一项前瞻性研究,旨在评估是否PNPLA3突变体的状态能帮助对肥胖的重度饮酒人群进行疾病风险分类,这些因素中的任何一种都会增加机体患肝病的风险,但研究结果表明,当一个人同时具备上述三种因素时,其患肝病的风险就会大幅增加。
研究者表示,相比未携带者而言,携带上述三种风险因素的个体患肝硬化的风险是前者的17.5倍,而仅携带PNPLA3突变体的个体患肝硬化的风险则是1.75倍,仅肥胖的个体患肝硬化的风险是1.76倍,仅过度饮酒的个体患肝硬化的风险是2.35倍;携带这三种风险因素的个体患肝癌的风险是未携带者的30.1倍,发生肝脏疾病相关死亡的风险则是21.8倍。
图片来源:https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2796933
研究者Hyunseok Kim博士说道,PNPLA3突变体对于改善肝脏疾病进展的风险分层至关重要,比如,携带PNPLA3突变体的个体会更加积极地接受关于饮酒习惯和BMI的相关资讯,其或许也可能是采取更多预防性措施的候选个体,比如更频繁地进行筛查以及进行高级别的成像分析。本文研究提供了一个独特的机会来研究PNPLA3、肥胖和过度饮酒在肝脏疾病风险中的预后作用;研究者Amos表示,我们并不经常会看到这种戏剧性的发现,因此我们对这些结果的临床意义感到非常兴奋。
【4】Science子刊:增加细胞中线粒体和脂质的周转或能降低机体患肝癌的风险
doi:10.1126/sciadv.abo2510
饮酒和丙肝病毒感染是引发肝细胞癌的已知风险因素,肝细胞癌是一种最常见的肝癌形式;除了这些因素外,肥胖相关的非酒精性脂肪肝如今也逐渐成为西方社会中人群患肝细胞癌的主要促进因素,然而目前研究人员并不清楚肥胖所诱导的肝癌发生背后的分子机制和原因。
近日,一篇发表在国际杂志Science Advances上题为“Lipid droplet turnover at the lysosome inhibits growth of hepatocellular carcinoma in a BNIP3-dependent manner”的研究报告中,来自芝加哥大学等机构的科学家们通过对小鼠模型进行研究后发现,剔除BNIP3蛋白或会降低线粒体和脂滴的周转率,从而导致脂肪肝发生,最终诱发机体患上肝癌,在人类肝癌中,研究者发现,缺失BNIP3的表达或许与脂质水平增加及患者预后较差直接相关。
研究者Kay Macleod博士说道:“我们的实验室非常感兴趣研究在正常生理状况下线粒体的功能及其周转,同时对于癌症状况下的相关情况我们也进行了研究。这项研究中,我们发现名为BNIP3的蛋白质或许能作为一种线粒体“货物受体”。正常情况下,小鼠机体中这种蛋白质在肝脏中的表达会明显上调从而对禁食产生反应,禁食在保护机体肝脏免于脂肪堆积方面扮演着关键作用,然而,剔除该蛋白或许会引发脂肪肝;因此研究人员就想通过进一步研究来理解在正常肝脏和肝癌中BNIP3蛋白的缺失诱发脂质积累的分子机制。”
为了理解BNIP3是如何参与脂质积累的预防以及脂肪肝等状况,研究人员使用化学致癌剂在两组小鼠中诱发了肝癌,其中一组是BNIP3完整的小鼠,另一组是BNIP3被剔除的小鼠;研究人员观察到,在BNIP3剔除的小鼠中,肿瘤发生地较早且生长迅速,此外,这些肿瘤中充满了脂肪,而在BNIP3完整的小鼠中,肿瘤较小且其中并不含有脂质;当随着时间延续对这些肿瘤进行追踪研究后,研究者发现,BNIP3完整的小鼠会发生与BNIP3剔除小鼠相似的脂质堆积现象,更有意思的是,BNIP3的功能已经被沉默了,这或许就表明,随着疾病的进展,机体或许会出现对BNIP3缺失的选择。
【5】JNCI:新型药物组合策略或有望增强肝癌患者机体的抗肿瘤免疫反应
doi:10.1093/jnci/djac051
免疫检查点阻断能联合抗血管生成疗法或能诱导血管正常化和机体的抗肿瘤免疫力,对于治疗肝细胞癌有一定的疗效;但最初的免疫疗法是否以及如何影响随后抗血管生成疗法的效率,目前研究人员并不清楚。近日,一篇发表在国际杂志Journal of the National Cancer Institute上题为“Increased CD8+ T-Cell Infiltration and Efficacy for Multikinase Inhibitors after PD-1 Blockade in Hepatocellular Carcinoma”的研究报告中,来自哈佛医学院等机构的科学家们通过研究开发了一种治疗肝细胞癌的新型疗法策略,其或能在使用多激酶抑制剂药物之前,首先利用免疫检查点抑制剂来处理肿瘤,从而有望帮助治疗患这种致命性疾病的患者;研究者指出,这种新型顺序方法(sequencing approach)或能增强双重药物疗法的治疗效率,并有可能降低长期使用药物的程度,从而减少患者毒性药物的暴露。
研究者Dan G. Duda说道,单独或联合使用多激酶抑制剂,随后再使用免疫检查点阻断剂,这种策略历来能够检测治疗肝细胞癌患者的疗法,然而目前没有人知道逆转这些疗法的治疗顺序可能会产生什么样的影响,于是研究者Duda决定在那些反向非标准顺序疗法下接受治疗的患者进行回顾性的分析来找出答案,当了解到在25名肝细胞癌患者队列中产生了良好的研究结果后,研究者将其研究扩展到了肝细胞癌小鼠的临床前模型中,结果发现,首先使用免疫检查点阻断疗法或能放大宿主机体的免疫反应,这或许会增强药物索拉非尼(sorafenib)的有效性并产生优越的治疗结果,索拉非尼是一种具有抗VEGFR(血管内皮生长因子受体)活性的标准多激酶抑制剂药物。

图片来源:https://academic.oup.com/jnci/advance-article-abstract/doi/10.1093/jnci/djac051/6547055?redirectedFrom=fulltext
肝细胞癌是人类所面临的第二大致命性的癌症类型,其每年在全球会造成大约70多万人死亡,同时也是肝癌最常见的形式;早在15年前,药物索拉非尼就已经成为了治疗肝癌的系统性疗法,作为一种抗VEGFR抑制剂,其能通过靶向作用滋养肿瘤病促进其进展的血管来控制肿瘤的癌变;就其本身而言,免疫检查点抑制剂就好像程序性细胞死亡1(PD1)抗体,其能恢复宿主机体免疫系统激活并杀灭癌细胞的能力,在去年一项重大研究发现中,研究者指出,免疫检查点阻断或能帮助重编程肿瘤血管中的微环境,当与多激酶抑制剂联合使用时或许就能导致肝细胞癌中更多的T细胞浸润和激活,正是这一研究发现或许就能改变免疫检查点抑制剂和多激酶抑制剂的使用顺序,从而就能帮助研究人员在临床前模型中观察到会发生什么改变。
【6】Sci Adv:我国科学家绘制原发性肝癌高分辨率空间分子图谱
doi:10.1126/sciadv.abg3750
异质性是癌症预防和治疗的主要挑战。近日,我国海军军医大学的研究团队在Science Advances发表了题为“Comprehensive analysis of spatial architecture in primary liver cancer”的文章。
文章中,研究人员对7例原发性肝癌患者的21个组织样本进行空间转录组学测序,得到84823个位点信息。通过将空间肿瘤微环境特征从非肿瘤区、边界区到肿瘤区进行渐进式比较,发现肿瘤包膜可能影响肿瘤内空间簇连续性、转录组多样性和免疫细胞浸润,并且发现肿瘤内部不同细胞亚群具有不同优势基因表达、细胞功能、预后以及克隆来源,且肿瘤细胞内部亚群并不独立,在彼此接触的范围(100 μm宽交界区)会发生广泛的配体-受体相互作用,同时发现肿瘤干细胞的富集与原发性肝癌的肿瘤侵袭和迁移呈正相关。通过开发一个新的用于鉴定三级淋巴结构的基因集,他们发现其高评分与原发性肝癌的较好预后显着相关。
该研究系统分析了肿瘤微环境中不同细胞类型或亚群的空间分布特征,绘制了原发性肝癌的高分辨率空间分子图谱。
【7】Hepatology:科学家开发出一种有望转化肝癌免疫疗法的新型策略
doi:10.1002/hep.32266
近年来,肿瘤免疫疗法已经成为了一种非常有前途且备受关注的肿瘤学方法,其基于利用称之为免疫检查点抑制剂(ICIs)的人源化抗体来阻断抑制T淋巴细胞活性的细胞通路,T淋巴细胞是一类能帮助保护机体抵御感染及癌症的重要的免疫细胞。最著名的抗体是针对CTLA-4、PD-L1和PD-1的抗体,然而,尽管使用免疫疗法治疗某些恶性肿瘤已经取得了令人鼓舞的成果,但大多数癌症患者对使用ICIs的疗法仍然反应不佳或根本没有反应,最明显的就是肝癌患者。
因此研究人员一直在尝试寻求新方法来改善免疫疗法的治疗效率,尤其是通过结合一种以上的疗法;目前有多种组合性疗法正在进行临床试验,但并没有临床前数据或明确的理由来证明联合疗法的可信度。近日,一篇发表在国际杂志Hepatology上题为“Enhancing the Therapeutic Efficacy of PD-L1 Antibody for Metastasized Liver Cancer by Overcoming Hepatic Immunotolerance”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究发现,通过串联使用一种被称之为polyIC的合成dsRNA分子来增强肝脏的先天性免疫力,就能使肝癌对一种名为抗PD-L1的免疫检查点抑制剂产生高度反应。

图片来源:https://pubmed.ncbi.nlm.nih.gov/34860431/
研究者Feng说道,在开发肝癌免疫疗法时我们有两个问题必须牢记,一般而言,肿瘤微环境的特点是进行免疫抑制,否则肿瘤就不会生长;另一个复杂的层面则是,肝脏是一个独特的免疫耐受性器官,其会不断暴露于食物中所获取的外来物质中,因此,成功的免疫治疗必须依赖于克服肝脏的免疫耐受并破坏肿瘤微环境中的免疫逃逸机制。为了解决这些问题,研究人员开发了两种小鼠肿瘤模型,其中一种是皮肤下生长肿瘤的模型,另一种则是肝脏内生长肿瘤的模型;这两种类型的肿瘤都来自于相同的结直肠癌细胞系,其能帮助研究人员特异性地调查不同肿瘤微环境所扮演的角色。
【8】Cell Metabol:科学家或能通过靶向作用肝细胞癌的超强代谢能力来开发新型抗癌疗法
doi:10.1016/j.cmet.2022.06.010
肝细胞癌是一种典型的致命性恶性肿瘤,其能表现出一定的遗传异质性和有限的治疗反应。近日,一篇发表在国际杂志Cell Metabolism上题为“GCN2 inhibition sensitizes arginine-deprived hepatocellular carcinoma cells to senolytic treatment”的研究报告中,来自宾夕法尼亚大学等机构的科学家们通过研究发现,肝癌的快速生长会导致其能量产生和细胞构建过程中的易感性,而这种易感性或能被一种新型组合性疗法来有效利用。
这项研究中,研究人员发现,作为最主要的肝癌类型,肝细胞癌能以一种特殊方式来改变其代谢,从而使其更容易受到名为精氨酸的关键分子供应中断的影响,这种精氨酸易感性存在于所有的肝细胞癌患者中,这与引起癌症发生的特殊遗传突变无关。研究人员在临床前实验中发现,让肝细胞癌肿瘤缺乏精氨酸并阻断由此所产生的促生存反应或能让肝细胞癌处于一种不生长的衰老状态,其或许能被一种靶向作用衰老细胞的新型药物所杀死。从本质上来讲,研究人员识别出了大多数肝癌的代谢特性,其或能为他们利用已经获批或正在研发的有效疗法治疗这些癌症提供一定的可能性。
肝细胞癌是成年人中最常见的肝癌类型,据美国癌症研究所数据显示,肝细胞癌在所有原发性肝癌(这种肝癌起源于肝脏而并不是从其它器官扩散过来的)中占到了大约80%的比例,每年都有大约2.9万美国人被确诊肝细胞癌,而全球大约有100万人被诊断为这类癌症,其被认为是由肝炎病毒、酗酒和肥胖所导致的慢性肝炎所引发的。肝细胞癌很少能被治愈,因为其往往是在疾病发展到无法利用手术进行切除时才被诊断出来,此外,能治愈良性疾病的肝脏移植通常对于晚期肝细胞癌患者而言是不可用的,针对肝细胞癌的药物疗法非常有限,而且其几乎从未被治愈过,因此,研究人员迫切需要研究开发出新型治疗性措施。
【9】Nat Sci Rev:科学家揭示人类肝细胞癌的动态表型异质性和多种RNA亚型的进化机制
doi:10.1093/nsr/nwab192
肿瘤内异质性(ITH)是癌症疗法的一个关键挑战,但此前研究都重点集中在基因组改变上,而并未深入分析表型(转录组和免疫)的异质性。近日,一篇发表在国际杂志National Science Review上题为“Dynamic phenotypic heterogeneity and the evolution of multiple RNA subtypes in Hepatocellular Carcinoma:the PLANET study”的研究报告中,来自中国科学院等机构的科学家们通过研究描述了肝细胞癌(HCC)中肿瘤异质性的动态基因组蓝图。
肝细胞癌是全球第七大最常见的癌症类型,但由于其所引发的较高的死亡率而成为全球第四大癌症相关的死亡原因;令人震惊的是,亚洲人群承担了不成比例的80%的疾病负担。尽管科学家们进行了大量努力,但目前并没有有效的预测性生物标志物来用于肝细胞癌的系统性治疗,且针对肝细胞癌的治疗效果仍然不佳。
图片来源:https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwab192/6414014
为此,PLANet研究计划的启动就是为了招募前瞻性的肝细胞癌患者队列,同时研究人员与亚太肝细胞癌试验组合作,在多个国家开展了该研究计划;具体而言,PLANet研究旨在理解名为肿瘤内异质性的肿瘤内部的分子多样性,以及临床医生如何利用这种理解来指导对患者的分层和治疗,早在2017年,研究人员就发现,肝细胞癌在不同患者中具有广泛的遗传性肿瘤内异质性。
当前的研究是基于来自PLANet研究中的4个亚洲国家中67名患者组成的队列,也是研究人员对肝细胞癌跨多组学数据层面(基因组、转录组和免疫学学)的首个肿瘤内异质性研究。研究者发现,相同肿瘤的不同区域或会在遗传(DNA突变)和转录组(RNA表达)方面出现变化,尤其是,他们发现,这种突变的水平在不同的患者机体中是不同的,且超过30%的患者会表现出高转录组的肿瘤内异质性,即一个单一的肿瘤或能包含多个转录组亚型。
【10】Cancer Res:新发现!抑癌基因p53若持续被激活或会促进人类肝癌发生!
doi:10.1158/0008-5472.CAN-21-4390
p53是癌症生物学中一种最重要的蛋白质,通常被称之为“基因组的守护者”,其会被激活用来对诸如DNA损伤等多种细胞压力产生反应,p53激活会诱导不同的过程,比如受控的细胞死亡,如果一个细胞变得异常,其就能预防其发生癌变以及癌症进展,正因为如此,p53的突变在癌症发生过程中极为常见,包括肝细胞癌等。近日,一篇发表在国际杂志Cancer Research上题为“Constitutive activation of the tumor suppressor p53 in hepatocytes paradoxically promotes non-cell autonomous liver carcinogenesis”的研究报告中,来自日本大阪大学等机构的科学家们通过研究观察到,遭受慢性肝脏疾病(CLD,chronic liver disease)的患者的肝脏细胞中p53的持续激活实际上会促进肝癌的发生。
慢性肝病的发生是由不同的因素所驱动,包括病毒、酒精使用和脂肪堆积等,所有这些因素都会诱导p53的激活,此前研究结果表明,p53在慢性肝病患者的肝脏细胞中会处于持续激活状态,然而,目前研究人员尚不清楚其在慢性肝病病理生理学机制中扮演着什么样的角色。研究者Yuki Makino说道,临床研究数据清楚地表明,p53会在慢性肝病患者的肝脏细胞中处于激活状态,因为p53是人体如何预防肿瘤形成的一个重要组成部分,其在慢性肝病中扮演的关键角色让其变得非常耐人寻味。
为了解决这一问题,研究人员开发了一种肝脏细胞中p53积累的小鼠模型,这类小鼠模型是通过剔除Mdm2蛋白所产生的,Mdm2是一种负责调节p53表达的特殊蛋白,其能对其进行靶向降解,这些小鼠模型常常会出现肝脏炎症,且肝细胞凋亡水平较高以及会出现衰老相关的分泌表型(SASP),这是一种细胞会在微环境中产生信号的现象,其会引发临近细胞发生癌变,实际上,机体中p53积累的小鼠肝脏肿瘤的发生几率会增加。研究者Tetsuo Takehara说道,我们还观察到肝脏祖细胞(HPCs)群体会扩张,其具有干细胞样的特征,当HPCs被分离出来后,对其进行培养,随后注射在实验室小鼠的皮下组织,这些动物就会发生肿瘤,这或许就表明,HPCs在p53积累的动物机体肝脏肿瘤形成过程中扮演着关键角色。
- 上一篇

European Radiology:Gd-BOPTA增强肝胆造影在预测肝癌患者肝切除术后肝功能衰竭中的价值
肝切除术后肝衰竭(PHLF)是肝切除术的致命并发症,也是围手术期发病率和死亡率的主要原因,还可导致医疗费用增加、住院时间延长和长期生存率下降。尽管手术技术和器械有很多改进,但 PHLF 的发生率仍然在1.2%到32%之间。对于肝细胞癌(HCC)患者来说,大多数患有慢性肝病和肝功能受损,因此进一步增加了PHLF的风险。肝功能储备良好的患者是手术切除的良好候选者
- 下一篇

European Radiology:肝癌的局部进展是否都与热消融有关?
肝细胞癌(HCC)因其高复发率而备受关注,其治疗效果及预后均较差。作为众多HCC治疗方法中的一种,热消融已被一些指南作物重要的根治性治疗手段推荐。由于其微创性、可重复性和成本效益,热消融已被临床实践所接受。然而,许多研究表明,热消融后的无复发生存率低于手术切除,且消融术后局部肿瘤进展(LTP)的发生率(15-20%)高于手术治疗(5-10%)。 LTP是一种

