Redox Biology : ESCC癌细胞如何利用代谢转换形成远处转移提供了新的见解
转移扩散通常会导致癌症的致命后果。新出现的证据表明,只有原发癌细胞的亚群进行多步骤重新编程,以获得侵蚀周围环境和逃避循环中的细胞凋亡的能力,才能在远处器官中形成转移灶。
另一方面,所有使转移细胞能够应对细胞外压力和陌生微环境的信号都可能构成癌症治疗的脆弱性。识别转移网络中的重要结节将提供新的机会,以改进抗癌治疗,超越目前的策略,并在转移过程中甚至转移前消除结节病变和细胞。

图片来源:https://doi.org/10.1016/j.redox.2022.102544
近日,来自广州肿瘤医学协同创新中心的研究者们在Redox Biology杂志上发表了题为“CPT1A promotes anoikis resistance in esophageal squamous cell carcinoma via redox homeostasis”的文章,该研究结果为ESCC癌细胞如何利用代谢转换形成远处转移提供了新的见解,并为ANOIKIS和FAO之间的联系提供了一些证据。
耐失巢细胞抵抗是肿瘤转移的显著标志,而脂质生成特性已被确认为肿瘤发生过程中的另一种代谢变化。然而,它们的串扰还没有完全阐明,特别是在晚期食管鳞癌(ESCC)中。在这项研究中,研究者首次通过代谢PCR芯片显示,在分离培养的ESCC细胞中,与脂肪酸氧化(FAO)有关的关键酶肉碱O-棕榈酰转移酶1(CPT1A)显著上调。
CPT1a的过度表达与ESCC患者的生存不良有关,并可通过供应GSH和NADPH来维持氧化还原平衡,从而保护ESCC细胞免于凋亡。从机制上讲,分离培养条件促进了转录因子ETV4的表达,抑制了泛素酶RNF2的表达,这两个因素分别导致CPT1a在mRNA和蛋白质水平上的表达增加。
此外,CPT1a的遗传或药物干扰切断了NADPH的供应,从而阻止了体外ESCC细胞的贴壁非定植生长和体内移植瘤模型的肺转移。
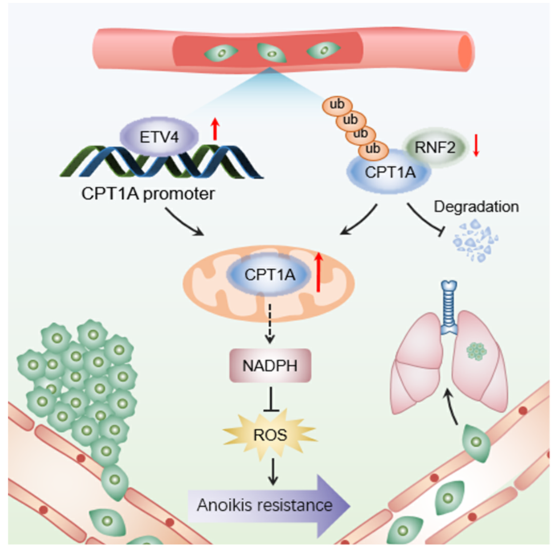
本研究的工作机制
图片来源:https://doi.org/10.1016/j.redox.2022.102544
总而言之,本研究的结果为ESCC癌细胞如何利用代谢转换形成远处转移提供了新的见解,并增加了临床前证据和理论基础,支持进一步研究粮农组织作为治疗ESCC的潜在治疗机会。( Bioon.com)
参考文献
Tian Tian et al. CPT1A promotes anoikis resistance in esophageal squamous cell carcinoma via redox homeostasis. Redox Biol. 2022 Dec;58:102544. doi: 10.1016/j.redox.2022.102544.
- 上一篇

BJP: 甘草酮A通过与MD2直接结合对抗内毒素诱导的炎症和急性肺损伤
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)是一种弥漫性肺损伤,具有几种病理特征,如肺血管通透性增加、间质水肿、上皮完整性破坏、免疫细胞募集和未控制或未消退的炎症。 尽管人们努力了解ALI/ARDS,但它仍然会在长期患者中导致各种呼吸道后遗症,在危重患者中甚至会导致显著的高死亡率。目前还没有FDA批准的可直接用于治疗ALI/ARDS的药物,因此需要开
- 下一篇

Redox Biology: 抑制铁死亡促进实验性视神经病变视网膜神经节细胞存活
视网膜神经节细胞(RGC)死亡是外伤性视神经病变、青光眼和其他导致不可逆性视力丧失的视神经疾病的标志。然而,挽救RGC丢失的治疗策略仍然具有挑战性,RGC丢失的分子机制尚未完全阐明。图片来源:https://doi.org/10.1016/j.redox.2022.102541 近日,来自天津医科大学总医院的研究者们在Redox Biology杂志上发表了题

