Redox Biology: 抑制铁死亡促进实验性视神经病变视网膜神经节细胞存活
视网膜神经节细胞(RGC)死亡是外伤性视神经病变、青光眼和其他导致不可逆性视力丧失的视神经疾病的标志。然而,挽救RGC丢失的治疗策略仍然具有挑战性,RGC丢失的分子机制尚未完全阐明。

图片来源:https://doi.org/10.1016/j.redox.2022.102541
近日,来自天津医科大学总医院的研究者们在Redox Biology杂志上发表了题为“Inhibition of ferroptosis promotes retina ganglion cell survival in experimental optic neuropathies”的文章,该研究结果表明,在实验性青光眼和ONC模型中,铁死亡是RGC调节细胞死亡的一种主要形式,并提示靶向线粒体依赖性铁死亡作为视神经病变中RGC损伤的保护策略。
在本研究中,研究者使用青光眼和视神经挤压(ONC)的实验模型,强调了铁死亡在RGC死亡中的作用。铁死亡是一种非凋亡性的程序性细胞死亡形式,其特征是铁依赖的致死性过氧化脂质积聚。
ONC治疗后大鼠视网膜谷胱甘肽过氧化物酶4(Gpx4)和XC系统半胱氨酸/谷氨酸逆向转运体(Xct)表达显著下调,同时脂质过氧化和铁水平升高。激光捕获显微切割和聚合酶链式反应证实了视网膜神经节细胞中Gpx4表达的降低。
透射电子显微镜显示视网膜神经节细胞线粒体形态发生改变,包括膜密度增加和线粒体脊减少。值得注意的是,在ONC和微珠诱导的青光眼小鼠模型中,铁死亡抑制剂铁蛋白-1(Fer-1)显著促进了RGC的存活并保护了视网膜功能。此外,与细胞凋亡抑制剂Z-VAD-FMK相比,Fer-1在挽救ONC视网膜RGC死亡方面显示出更好的效果。
从机制上讲,研究者发现Gpx4的下调主要发生在线粒体室,并伴随着线粒体活性氧(ROS)和过氧化脂质的增加。线粒体选择性抗氧化剂MitoTEMPO减轻了ONC后RGC的丢失,提示线粒体ROS和脂质过氧化是铁死亡诱导ONC视网膜RGC死亡的主要机制。值得注意的是,Fer-1有效地阻止了ONC视网膜线粒体过氧化脂质的产生,线粒体5‘-三磷酸(ATP)产生的损害,以及线粒体基因如mt-cytb和MT-ATP6的下调。
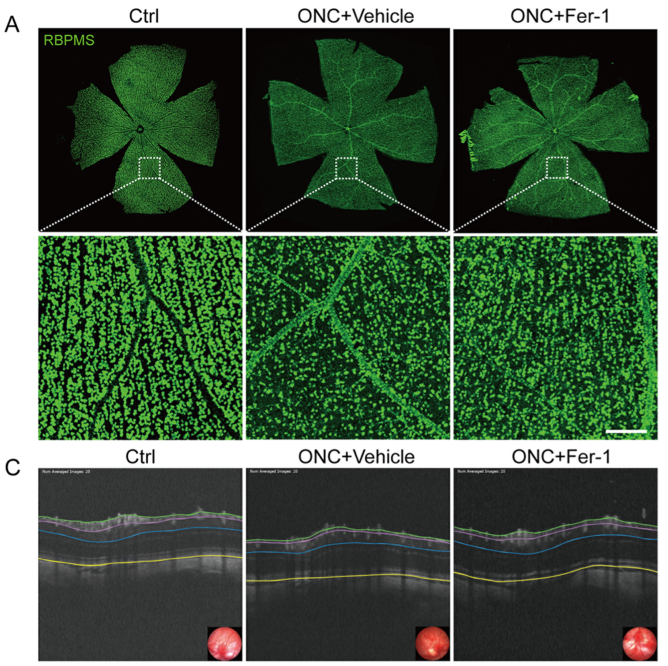
FER-1对ONC引起的RGC丢失、视网膜厚度减少和视网膜功能损害具有保护作用
图片来源:https://doi.org/10.1016/j.redox.2022.102541
综上所述,本研究揭示了线粒体依赖的铁死亡介导视神经损伤后RGC死亡的新机制,可能为减少视神经疾病中RGC变性发现新的治疗靶点。(Bioon.com)
参考文献
Miao Guo et al. Inhibition of ferroptosis promotes retina ganglion cell survival in experimental optic neuropathies. Redox Biol. 2022 Dec;58:102541. doi: 10.1016/j.redox.2022.102541.
- 上一篇

Redox Biology : ESCC癌细胞如何利用代谢转换形成远处转移提供了新的见解
转移扩散通常会导致癌症的致命后果。新出现的证据表明,只有原发癌细胞的亚群进行多步骤重新编程,以获得侵蚀周围环境和逃避循环中的细胞凋亡的能力,才能在远处器官中形成转移灶。 另一方面,所有使转移细胞能够应对细胞外压力和陌生微环境的信号都可能构成癌症治疗的脆弱性。识别转移网络中的重要结节将提供新的机会,以改进抗癌治疗,超越目前的策略,并在转移过程中甚至转移前消除结
- 下一篇
细胞在胚胎发生过程中构建组织时如何感知其机械环境
德累斯顿工业大学和加州大学圣巴巴拉分校卓越生命物理集群的一个研究小组揭示了细胞在胚胎发生过程中构建组织时如何感知其机械环境。构建组织和器官是细胞在胚胎发生过程中必须完成的最复杂和最基本的任务之一。在这项集体任务中,细胞通过各种交流方式进行交流,包括生化信号(类似于细胞的嗅觉)和机械信号(细胞的触觉)。几十年来,各种学科的研究人员一直对细胞通信着迷。Otger

