2022年终盘点:人工智能如何改善人类健康?
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在人工智能改善人类健康研究领域取得了多项重磅级研究成果,本文中,小编就对本年度科学家们在该研究领域取得的相关研究成果进行整理,分享给大家!
【1】PNAS:科学家将微流体技术与人工智能技术结合来改善人类癌症免疫疗法
Zheng Ao,Hongwei Cai,Zhuhao Wu,et al. Microfluidics guided by deep learning for cancer immunotherapy screening,Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2214569119
免疫细胞浸润和细胞毒性在机体炎症和免疫疗法过程中扮演着关键的角色,然而,当前的癌症免疫疗法筛查手段忽略了T细胞能穿透肿瘤基质的能力,从而就大大限制了开发治疗实体瘤的有效疗法。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Microfluidics guided by deep learning for cancer immunotherapy screening”的研究报告中,来自印第安纳大学等机构的科学家们通过研究将一种“芯片实验室”(lab-on-a-chip)技术与人工智能技术相结合来改善癌症免疫疗法。研究人员所开发的这种原型平台或许有助于自动的药物筛选和实时3D成像,并能进行免疫细胞和癌细胞之间相互作用的分析。
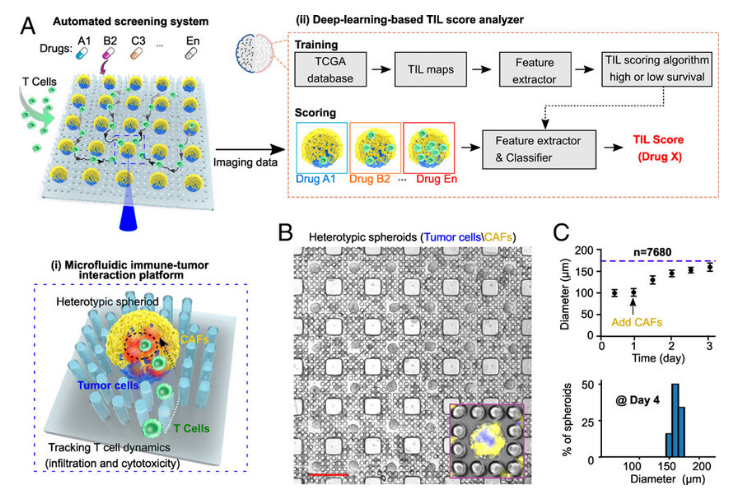
科学家将微流体技术与人工智能技术结合来改善人类癌症免疫疗法。
图片来源:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2214569119
研究者Guo说道,我们能利用所开发的平台来观察不同的疗法是如何影响对靶向癌细胞的杀灭效率的,甚至是肿瘤浸润等,其是非常独特的。这种平台能利用微流体技术(所谓的芯片实验室技术)结合称之为深度学习的人工智能技术,微流体技术是在微观渠道进行流体操控的技术,其基本上是将不同的实验室功能扩展到一个微芯片上;深度学习是一种基于生物神经网络为灵感的计算系统的一种机器学习手段,将这两种技术结合在一起能促进平台快速且自动识别潜在的癌症免疫疗法药物,并检测其在细胞水平上是如何发挥作用的。
据研究者介绍,实体瘤能表现出绝大多数人类癌症的特征,然而当前的癌症免疫疗法筛查手段忽略了T细胞穿透实体瘤组织的能力。研究者Ming Dao说道,癌症免疫疗法在治疗人类癌症上确实取得了巨大成功,但人类在征服癌症上依然面临着艰巨的挑战;对于大部分实体瘤而言,研究人员很难开发出一种有效的疗法来浸润并杀灭疾病细胞,因此他们旨在开发一种新型的肿瘤免疫疗法筛选平台,来动态追踪T细胞的肿瘤渗透和肿瘤细胞的杀伤效应,并能以一种高通量和自动化的方式来扫描多种潜在的药物。
【2】Nat Biomed Eng:中国科学家开发出基于人工智能技术的抗体研究模型
Zhang, J., Du, Y., Zhou, P. et al. Predicting unseen antibodies’ neutralizability via adaptive graph neural networks. Nat Mach Intell 4,964–976 (2022). doi:10.1038/s42256-022-00553-w
在人类与病毒性病原体的博弈中,发现强有力的中和抗体(neutralizing antibody,nab)应用于治疗是重要“武器”之一。在天然抗体或人工设计抗体中,作用机制和中和能力的研究过程,往往需要耗费大量的实验来检测和探究,同时也是“人与病毒”赛跑中的关键限速环节。如何快速、精准预测未知抗体的中和能力及其作用靶点,在传统的抗体药物研发领域中仍需进一步突破的关键科学问题。
近日,一篇发表在国际杂志Nature Machine Intelligence上题为“Predicting unseen antibodies' neutralizability via adaptive graph neural networks”的研究报告中,来自复旦大学基础医学院等机构的科学家们通过研究首次提出了一个深度“抗体-抗原”交互算法模型(a deep Ab-Ag interaction algorithm,简称DeepAAI)。DeepAAI有别于经典的序列比对的方法,而是通过深度学习的方法“动态适应性地”学习未知抗体与已知抗体的关系(Adaptive Relation Graph),从而避免了AI算法对于未知抗体冷启动的问题,达到有效地预测未知抗体的中和能力。此外,DeepAAI还具有较好的解释性,能为抗原抗体的结合位点提供线索;分析同一病毒不同变种和亚变种之间的相似关系,为某病毒出现的新亚种推荐可能的中和抗体。
DeepAAI另一个特点是它基于序列数据。虽然真实的三级结构数据能提高AI算法的预测准确性,但是现实世界(real-world)中大量抗体的三级结构是未知的。DeepAAI放弃了先根据序列预测结构,再随后根据预测出的结构再预测抗原抗体相互作用的这种串联AI算法的模式,而是直接基于序列提取足够的有效特征用于预测相互作用。这就避免了“在第1步中的误差在第2步中被累积和指数级放大”的风险。同时,现实世界中大量存在的序列数据也可以增强AI算法的实用性。
【3】Nat Biomed Eng:能自我学习的人工智能技术或能利用病理学图像来寻找类似的患者病例 从而帮助诊断人类罕见疾病
Chen, C.,Lu,M.Y.,Williamson,D.F.K. et al. Fast and scalable search of whole-slide images via self-supervised deep learning. Nat Biomed Eng (2022). doi:10.1038/s41551-022-00929-8
罕见疾病通常难以诊断,而预防针对罕见病患者的最佳疗法对于临床医生而言也是一项巨大挑战。近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Fast and scalable search of whole-slide images via self-supervised deep learning”的研究报告中,来自美国布莱根妇女医院等机构的科学家们通过研究开发了一种深度学习算法,其或能通过自学方式来学习用于在大型病理学图像库中寻找类似病例的特征。
这种名为SISH(用于组织学的自我监督图像搜索Self-Supervised Image search for Histology)的工具就好像一种进行病理图像分析的搜索引擎,其拥有多种潜在的应用,包括识别罕见疾病并帮助临床医生确定哪些病人可能会对类似的疗法产生反应。研究者Faisal Mahmood说道,本文研究结果表明,我们的系统能帮助诊断罕见疾病并在不需要注释的前提下寻找具有类似形态模式的病例,也并不需要用于监督训练的大规模数据库;这种系统或有望改善病理学的训练、疾病亚型划分、肿瘤的鉴定仪及罕见形态学的鉴定等。
现代的电子数据库能存储大量的数字记录和参考图像,尤其是在病理学中通过整张幻灯片图像,然而每个单独的整张图像的千兆像素的大小仪及大型数据库中不断增加的图像数量意味着,对图像的搜索和检索是可能缓慢且非常复杂的,因此,其可扩展性仍然是有效使用的一个相关的障碍。为了解决这个问题,研究人员就开发了SISH,并让其自我学习相关特征,无论数据库的大小,其都能以恒定的速度找到病例学中具有类似特征的病例。
【4】三篇Science:人工智能或能比以前更准确和更快速地用来构建蛋白分子
1. Jue Wang et al. Scaffolding protein functional sites using deep learning. Science, 2022, doi:10.1126/science.abn2100.
2. J. Dauparas et al. Robust deep learning based protein sequence design using ProteinMPNN. Science, 2022, doi:10.1126/science.add2187.
3. B.I.M.Wicky et al. Hallucinating symmetric protein assemblies. Science, 2022, doi:10.1126/science.add1964.
最近,包括AlphaFold和RoseTTAFold在内的强大的机器学习算法经训练后可以完全根据氨基酸序列预测天然蛋白的详细形状。机器学习是一种人工智能,它允许计算机从数据中学习,而无需明确编程。机器学习可用于对人类难以理解的复杂科学问题进行建模。为了超越自然界中发现的蛋白,Baker团队成员将蛋白设计的挑战分解为三个部分,并针对每个部分使用新的软件解决方案。
首先,必须生成一种新的蛋白形状。在第一篇论文中,Baker团队指出人工智能可以通过两种方式生成新的蛋白形状。第一种方法被称为幻化(hallucination),类似于DALL-E或其他根据简单的提示产生输出的生成型人工智能工具。第二种方法被称为“图像修复(inpainting)”,类似于现代搜索栏中的自动完成功能。相关研究结果“Scaffolding protein functional sites using deep learning”发表在Science期刊上。
其次,为了加速这一过程,Baker团队设计了一种新的算法来生成氨基酸序列。在第二篇论文中,他们描述了这种称为ProteinMPNN的软件工具,它的运行时间约为一秒。这比以前最好的软件快200多倍。其结果优于之前的工具,而且该软件不需要专家定制就能运行。相关研究结果“Robust deep learning–based protein sequence design using ProteinMPNN”发表在Science期刊上。
第三,Baker团队使用Alphabet旗下DeepMind公司开发的工具AlphaFold,独立评估他们得出的氨基酸序列是否有可能折叠成预定的形状。Dauparas解释说,“预测蛋白结构的软件是解决方案的一部分,但它自己不能提出任何新的东西。”Baker补充说,“ProteinMPNN对于蛋白设计来说,就像AlphaFold对于蛋白结构预测一样。”在第三篇论文中,Baker团队证实组合使用新的机器学习工具能够可靠地生成在实验室中发挥作用的新蛋白。相关研究结果“Hallucinating symmetric protein assemblies”发表在Science期刊上。
【5】Age & Ageing:科学家开发出能降低常见药物副作用的的新型人工智能工具
Agostina Secchi, Hulkar Mamayusupova, Saber Sami, et al. A novel Artificial Intelligence-based tool to assess anticholinergic burden: a survey,Age and Ageing (2022). DOI:10.1093/ageing/afac196
许多药物都具有抗胆碱活性,使用这些药物或与包括认知影响等多种严重的不良反应有关。近日,一篇发表在国际杂志Age and Ageing上题为“A novel Artificial Intelligence-based tool to assess anticholinergic burden: a survey”的研究报告中,来自英国埃克塞特大学等机构的科学家们通过研究评估了一种新型工具,其能帮助计算哪种药物最有可能会对机体和大脑产生不良的抗胆碱影响,很多处方药和非处方药都可能会产生这些并发症,这些药物通常会通过阻断名为乙酰胆碱对的关键神经递质来影响大脑的功能,包括一些膀胱药物、抗抑郁药物、胃病药物和帕金森疾病药物在内的多种药物都具有一定程度的抗胆碱能效应,而这些药物通常会被老年人所摄入。

科学家开发出能降低常见药物副作用的的新型人工智能工具。
图片来源:Age and Ageing (2022). DOI:10.1093/ageing/afac196
抗胆碱能的副作用包括意识混乱、视力模糊、头晕、跌倒和大脑功能下降,抗胆碱能效应也会增加跌倒的风险,并可能会与患者的死亡率增加有关;长期使用这些药物或许与个体患痴呆症风险增加直接相关。如今,研究人员所开发的这种新型工具能利用人工智能技术来帮助计算这些药物所产生的有害效应,这种新型的线上工具名为国际抗胆碱认知负担工具(IACT,International Anticholinergic Cognitive Burden Tool)使用自然语言处理(一种人工智能方法学)和化学结构分析来识别具有抗胆碱能效应的药物。
这种工具是首个结合机器学习技术的工具,其旨在开发一种可在门户网站上自动更新的工具,评估抗胆碱能负担的方法是基于对报告的不良事件进行评分,并与考虑开具处方的药物的化学结构紧密结合,从而就形成了一种要比以往任何系统都更为准确和最新的评分系统;最终,经过进一步的研究和对现实世界病人数据的建模,所开发的工具或能帮助支持减少普通药物风险的处方开具。
【6】Matter:研究人员开发一种支持人工智能的新型光纤传感器装置可以帮助监测脑损伤
Yuqian Zhang,Yubing Hu,Qiao Liu, et al. Multiplexed optical fiber sensors for dynamic brain monitoring, Matter (2022). DOI:10.1016/j.matt.2022.07.024
近日,一篇发表在国际杂志Matter上题为“Multiplexed optical fiber sensors for dynamic brain monitoring”的研究报告中,来自伦敦帝国理工学院等机构的科学家们通过研究开发出了一种新型人工智能光纤传感器装置,其或能同时测量创伤性脑损伤的关键生物标志物。
动物脑组织测试的“有希望”结果表明,它可以帮助临床医生比目前更好地监测疾病进展和患者对治疗的反应,这表明未来在人类中进行诊断试验的潜力很大。头部受到严重打击的人,例如在道路交通事故中,可能会遭受脑外伤(TBI)——这是世界范围内导致死亡和残疾的主要原因,可能导致记忆、注意力和解决问题的长期困难。
治疗期间需要持续监测TBI。因此,在神经危重症护理环境中使用颅内探头来监测损伤进展的关键指标,称为生物标志物,如大脑中的压力和氧气。其中一些探针一次只能测量一种生物标志物。其他人可以监测多种生物标志物,但需要将几根管子插入大脑,这有可能导致进一步的组织损伤或感染。
帝国研究院的研究人员现在开发了一种患者监测系统,用于监测创伤性脑损伤后的多种生物标志物。该设备将同时监测四种生物标志物的能力与机器学习算法相结合,机器学习算法使用以前的数据基于获得的数据实时预测生物标志物浓度。如果经过优化并证明可用于人体,该设备可以帮助医院更有效地监测TBI。
【7】 Nat Med:利用人工智能通过读取人们的呼吸模式就能检测出帕金森病
Yang, Y.,Yuan, Y.,Zhang,G. et al. Artificial intelligence-enabled detection and assessment of Parkinson’s disease using nocturnal breathing signals. Nat Med 28, 2207–2215 (2022). doi:10.1038/s41591-022-01932-x
帕金森病是出了名的难以诊断,因为它主要依赖于运动症状的出现,如震颤、僵硬和迟钝,但这些症状往往在发病几年后出现。近日,一篇发表在国际杂志Nature Medicine上题为“Artificial intelligence-enabled detection and assessment of Parkinson’s disease using nocturnal breathing signals”的研究报告中,来自美国麻省理工学院等机构的科学家们通过研究开发出一种人工智能模型,其仅仅通过读取一个人的呼吸模式就能检测出帕金森病。
这种工具是一种神经网络,是一系列模拟人脑工作方式的关联算法,能够从一个人的夜间呼吸---睡眠时的呼吸模式--来评估这个人是否患有帕金森病。这种由麻省理工学院博士生Yuzhe Yang和博士后Yuan Yuan训练的神经网络还能够辨别人们所患的帕金森病的严重程度,并跟踪其疾病的进展。多年来,科学家们已经研究了使用脑脊液和神经影像学检测帕金森病的潜力,但这类方法具有侵入性,成本高,并且需要进入专门的医疗中心,因此不适合进行频繁的可以提供早期诊断或持续跟踪疾病进展的测试。
这些作者证实对帕金森病的人工智能评估可以每天晚上在家里趁人睡着时进行,而且不需要接触他们的身体。为此,他们开发了一种外观像家用Wi-Fi路由器的设备,但该设备不提供互联网接入,而是发射无线电信号,分析这些信号在周围环境中的反射,并在不接触身体的情况下提取受试者的呼吸模式。然后,呼吸信号被提供被这种神经网络,以被动的方式评估帕金森病,而且患者和护理人员不需要做任何工作。
研究者Katabi表示,早在1817年,在James Parkinson的研究中就注意到了帕金森病与呼吸之间的关系。这促使我们考虑从一个人的呼吸中检测这种疾病的潜力,而不用观察运动。一些医学研究已表明,呼吸系统症状在运动症状之前几年就已表现出来,这意味着呼吸特性在帕金森病诊断之前可能是有前景的风险评估。作为世界上增长最快的神经系统疾病,帕金森病是继阿尔茨海默病之后第二大最常见的神经系统疾病。仅在美国,它就困扰着100多万人,每年的经济负担达519亿美元。这些作者开发的设备在7687人身上进行了测试,包括757名帕金森病患者。
【8】Science:对人工智能进行训练,构建有潜力用作药物和疫苗的蛋白
JUE WANG,SIDNEY LISANZA,DAVID JUERGENS,et al. Scaffolding protein functional sites using deep learning. Science,2022,doi:10.1126/science.abn2100.
近日,一篇发表在国际杂志Science上题为“Scaffolding protein functional sites using deep learning”的研究报告中,来自美国华盛顿大学医学院等机构的科学家们通过研究开发出了一种新型的人工智能软件,并利用它构建出可能作为疫苗、癌症治疗、甚至是将碳污染物从空气中分离出来的工具的蛋白。
研究者David Baker表示,我们在自然界发现的蛋白是神奇的分子,但设计的蛋白可以做得更多。在这项新的研究中,我们发现机器学习可以用来设计具有一系列功能的蛋白。几十年来,科学家们一直使用计算机来尝试设计蛋白。一些蛋白,如抗体和合成结合蛋白,已被改进为药物来对抗COVID-19。其他蛋白,如酶,有助于工业生产。但是一个蛋白分子往往包含数千个键合原子;即使有专门的科学软件,它们也很难研究和设计。
受到机器学习算法如何从提示中生成故事甚至图像的启发,这些作者着手构建类似的软件来设计新蛋白。研究者指出,这个想法是一样的:神经网络可以经训练后观察数据中的模式。一旦经过训练,你可以给它一个提示,看看它是否能产生一个优雅的解决方案。结果往往是引人注目的,甚至是不错的。”这些作者使用来自蛋白数据库(Protein Data Bank)的信息训练了多个神经网络,该数据库是一个公共资源库,包含了来自所有生命王国的数十万种蛋白结构。所产生的神经网络甚至让构建它们的科学家们感到惊讶。
这些作者开发出两种方法来设计具有新功能的蛋白。第一种称为“幻化(hallucination)”的方法类似于DALL-E或其他生成型人工智能工具,根据简单的提示产生新的输出。第二种称为“图像修复(inpainting)”的方法类似于现代搜索栏和电子邮件客户端中的自动完成功能。
【9】Nat Commun:利用人工智能成功预测癌症患者对免疫疗法的反应
JungHo Kong,Doyeon Ha,Juhun Lee, et al. Network-based machine learning approach to predict immunotherapy response in cancer patients. Nature Communications, 2022, doi:10.1038/s41467-022-31535-6.
作为一种新的癌症治疗方法,免疫疗法激活人体的免疫系统来对抗癌细胞,而不使用化疗或放疗。它比传统的抗癌药物有更少的副作用,因为它只利用人体的免疫系统攻击癌细胞。此外,由于它利用了免疫系统的记忆和适应性,从它的治疗效果中受益的患者会有持续的抗癌效果。
近期开发的免疫检查点抑制剂(immune checkpoint inhibitor, ICI)已经极大地改善了癌症患者的生存率。然而,癌症免疫疗法的问题是,只有大约30%的癌症患者从它的治疗效果中获益,而且目前的诊断技术不能准确预测患者对这种治疗的反应。在这种背景下,近日,一篇发表在国际杂志Nature Communications上题为“Network-based machine learning approach to predict immunotherapy response in cancer patients”的研究报告中,来自韩国浦项科技大学和延世大学等机构的研究人员通过使用基于网络的机器学习,提高了预测患者对免疫检查点抑制剂作出反应的准确性。
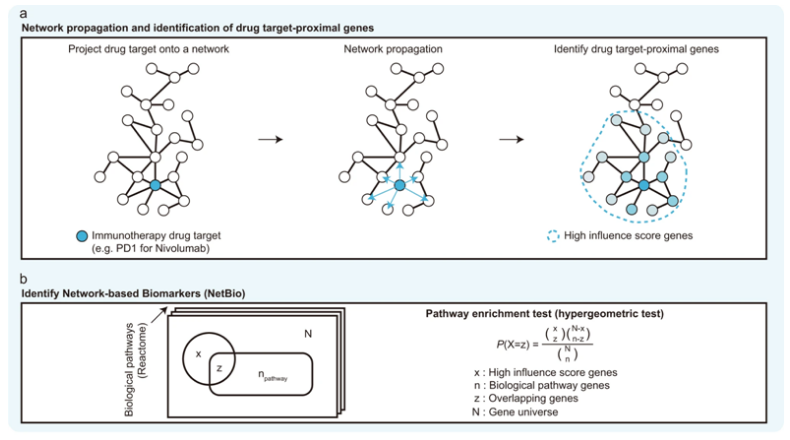
一种基于网络的机器学习(ML)方法来识别免疫疗法相关的生物标志物。
图片来源:Nature Communications, 2022, doi:10.1038/s41467-022-31535-6。
这些作者通过分析700多名三种不同癌症(黑色素瘤、胃癌和膀胱癌)患者的临床结果以及患者癌症组织的转录组数据,发现了新的基于网络的生物标志物。通过利用基于网络的生物标志物,他们成功开发出可以预测抗癌治疗反应的人工智能方法。他们进一步证实这种基于新发现的生物标志物的治疗反应预测优于基于常规抗癌治疗生物标志物(包括免疫治疗靶标和肿瘤微环境标志物)的预测。
【10】STTT:揭示人工智能在癌症靶点识别和药物发现中的应用
Yujie You,Xin Lai,Yi Pan,et al. Artificial intelligence in cancer target identification and drug discovery. Signal Transduct Target Ther. 2022 May 10;7(1):156. doi: 10.1038/s41392-022-00994-0.
靶向药物治疗作为肿瘤治疗的前沿之一,具有疗效高、副作用少、患者耐药低等优点。然而,现有的靶向治疗有几个缺点,例如少数可用药的靶点,对患者人群的覆盖不有效,以及缺乏对患者耐药性的替代反应。因此,寻找新的治疗靶点并评价其可药性成为当前靶向药物治疗的肿瘤研究热点。由于疾病的复杂性,我们很难全面了解癌症的发病机制,目前大多数靶向药物都是基于实验验证的假说开发的,该假说可以解释癌症发生的可能机制,但忽略了疾病的其他事实。因此,这些疗法可能会对正常组织产生不良影响,甚至会给患者带来严重的副作用。
近日,来自四川大学的研究者们在Signal Transduction and Targeted Therapy杂志上发表了题为“Artificial intelligence in cancer target identification and drug discovery”的综述性文章,该研究揭示了人工智能模型为我们提供了一个定量框架,以研究网络特征与癌症之间的关系,从而识别潜在的抗癌靶点,并发现新的候选药物。
人工智能是从生物网络中识别新的抗癌靶点和发现新药物的先进方法,因为这些网络可以有效地保存和量化癌症等人类疾病相关细胞系统组件之间的相互作用。在这里,研究者回顾和讨论如何使用人工智能方法来识别新的抗癌靶点和发现药物。首先,研究者描述了用于抗癌新靶点研究的人工智能生物分析的范围。其次,回顾和讨论了常用的基于网络和基于机器学习的人工智能算法的基本原理和理论。最后,研究者展示了人工智能方法在癌症目标识别和药物发现中的应用。
【11】Nature:利用人工智能确定了癌症中的21种拷贝数标记
Steele,C.D.,Abbasi,A.,Islam,S.M.A. et al. Signatures of copy number alterations in human cancer. Nature 606, 984–991 (2022). doi:10.1038/s41586-022-04738-6
近日,一篇发表在国际杂志Nature上题为“Signatures of copy number alterations in human cancer”的研究报告中,来自英国癌症研究学院等机构的科学家们通过研究利用人工智能(AI)研究并分类了癌症起始和生长时基因组中DNA变化的大小和规模。
利用人工智能,这些作者确定了21种常见的缺陷,这些缺陷发生在癌症起始和生长时的DNA结构、顺序和拷贝数上。一类称为拷贝数标记(copy number signature)的常见缺陷可能帮助指导医生进行反映肿瘤特征的治疗。当你观看美国流媒体播放平台Netflix时,会产生关于你观看的电影和电视剧类型的数据,你观看它们的频率,以及你是否给它们一个“大拇指”或“小拇指”。Netflix使用一种算法来分析这些大量的数据,在你观看的内容中找到模式,然后在你滚动浏览Netflix时推荐新的电影和电视剧。
文章中,研究人员构建出一种类似的算法,可以筛选出成千上万行的基因组数据,挑出染色体如何组装和排列的共同模式。然后,该算法可以对出现的模式进行分类,并帮助科学家们确定癌症中可能出现的缺陷类型。利用该算法,这些作者在9873名患有33种不同类型癌症的患者的完全测序的基因组中寻找模式。该算法确定了肿瘤中染色体结构和数量的21种常见缺陷,并将它们归类为不同的拷贝数标记。
【12】Science:利用基于人工智能的结构预测分析人类核孔复合体
SHYAMAL MOSALAGANTI,AGNIESZKA OBARSKA-KOSINSKA,MARC SIGGEL,et al. AI-based structure prediction empowers integrative structural analysis of human nuclear pores. Science, 2022, doi:10.1126/science.abm9506.
真核生物的细胞核保护着基因组,被核包膜的两层膜所包围。核孔复合体(Nuclear pore complex, NPC)穿过核包膜以促进核质运输。人类NPC的分子量为120兆道尔顿(MDa),是最大的蛋白复合体之一。它共有约1000个蛋白,由一组约30个不同的核孔蛋白(nucleoporin, NUP)组成,每个NUP存在许多个拷贝。它们可以粗略地分为两类:支架型NUP和天然无序NUP。支架型NUP含有折叠的结构域,并在一个中心通道周围形成一个圆柱形的支架结构。天然无序NUP排列在这种支架结构上并延伸到这个中央通道,在那里它们与货物复合物相互作用。NPC的结构是高度动态的。它通过构象呼吸(conformational breathing)对核包膜张力的变化做出反应,表现为扩张和收缩运动。阐明原子分辨率下的支架结构对于更精确地了解NPC的功能和动态非常重要,但这对结构生物学家来说是一个巨大的挑战。
近日,一篇发表在国际杂志Science上题为“AI-based structure prediction empowers integrative structural analysis of human nuclear pores”的研究报告中,来自德国马克斯-普朗克生物物理研究所等机构的科学家们通过研究使用基于人工智能(AI)的预测,生成了大量的人类NUP及其亚复合物的结构模型。所产生的模型涵盖了迄今为止在结构上尚未表征的多种结构域和界面。与以前的和未发表的X射线和低温电镜结构进行比对,显示出前所未有的准确性。
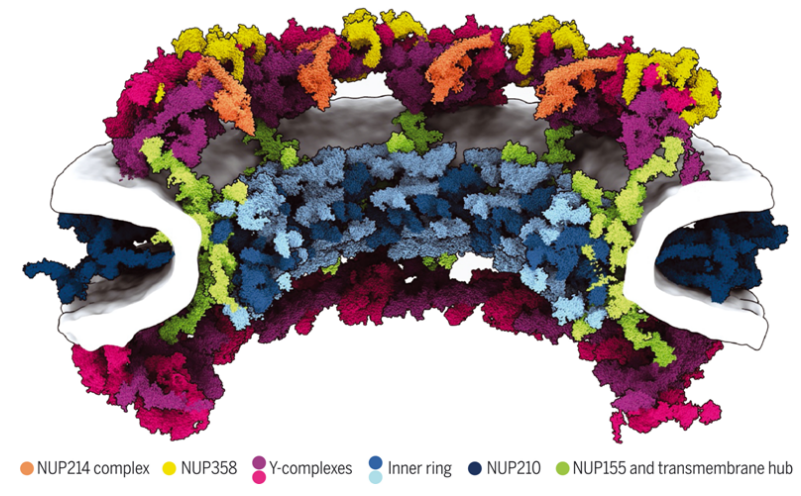
70-MDa人核孔复合体支架结构模型
图片来源:Science, 2022, doi:10.1126/science.abm9506。
这些作者获得了人类NPC的收缩和扩张构象状态的高分辨率低温电子断层图。利用综合建模,他们将单个NUP的结构模型整合到低温电子断层图中。他们明确地纳入了几种起连接作用的NUP,并追踪它们在NPC支架上的轨迹。他们非常详细地阐明了膜相关NPC和跨膜NUP如何分布在内外核膜的融合拓扑结构中。由此产生的结构模型将人类NPC支架的结构覆盖率提高了约两倍。他们对照早期和新的实验数据广泛地验证了他们的模型。他们的模型的完整性使他们能够在一种明确的膜环境和溶剂中对NPC支架进行微秒级的粗粒度分子动力学模拟。这些模拟显示NPC支架在没有膜张力的情况下,可以防止原本稳定的双膜融合孔收缩到较小的直径。
【13】Nat Commun:利用人工智能技术和机器人系统结合来识别隐藏的帕金森疾病特征
Lauren Schiff,Bianca Migliori,Ye Chen, et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts, Nature Communications, DOI:10.1038/s41467-022-28423-4
诸如帕金森疾病等疾病的药物发现往往由于缺乏可筛选的细胞表型而受到阻碍;近日,一篇发表在国际杂志Nature Communications上题为“Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts”的研究报告中,来自美国的科学家们通过研究开发了一种能帮助发现疾病细胞特征的新平台,其或能将研究患者细胞的机器人系统与进行成像分析的人工智能方法相结合,利用这种自动化的细胞培养平台,研究人员通过创建并分析来自91名患者和健康对照个体的超过100万个皮肤细胞图像,成功识别出了帕金森疾病的新型细胞标志。
研究者Susan L. Solomon表示,传统的药物发现或许并不奏效,尤其是在研究诸如帕金森疾病等复杂疾病上,这种名为NYSCF的机器人技术或能帮助我们从大规模的患者群体中产生大量的数据,同时还能帮助发现新的疾病特征,并作为发现真正有效药物的全新基础;这或许是利用人工智能技术在疾病研究方面的一种理想的展示,本文研究中,研究人员利用NYSCF庞大的患者细胞库和最先进的机器人系统对来自91名帕金森疾病患者和健康对照个体的数百万个细胞图像进行分析,随后研究者利用微阵列来从皮肤穿孔活组织样本中分离并扩大称之为成纤维细胞的皮肤细胞,并利用细胞绘图的技术来标记这些细胞的不同部分,从而创建出了成千上万张高含量的光学显微镜图像,研究者所得到的的图像被送入了一种无偏见、人工智能所驱动的成像分析管线中,从而就能帮助他们识别出针对患者细胞特异性的图像特征,其还能被从来与健康对照个体进行有效区分。
研究者Samuel J. Yang说道,这些人工智能方法或能帮助确定患者机体的细胞有哪些共同点,而这些共同点或许是无法被观察到,同样重要的是,这些算法是无偏见的,其并不依赖于任何关于帕金森疾病的知识或先入为主的观念,因此研究人员就能发现全新的疾病特征。最近,基于特定疾病靶点和被认为是疾病驱动因素的通路而发现的临床试验的失败率较高,这或许凸显出了对帕金森疾病新特征研究的需求,而使用无偏见的方法来发现这些疾病特征(尤其是在患者群体中)对于诊断和药物发现非常有价值,甚至还能揭示患者之间新的区别。
【14】Nat Med:科学家有望利用人工智能技术来准确诊断人类的前列腺癌
Bulten, W.,Kartasalo, K.,Chen,PH.C. et al. Artificial intelligence for diagnosis and Gleason grading of prostate cancer: the PANDA challenge. Nat Med (2022). doi:10.1038/s41591-021-01620-2
如今人工智能(AI)技术已经显示出了在活检中诊断前列腺癌的前景,然而,其结果仅限于个别研究,缺乏多国环境的验证;而且竞争已经被证明是医学成像创新研究领域的加速器,但其影响常常因缺乏可重复性和独立验证而受到了一定的阻碍。近日,一篇发表在国际杂志Nature Medicine上题为“Artificial intelligence for diagnosis and Gleason grading of prostate cancer: the PANDA challenge”的研究报告中,来自拉德堡德大学医学中心等机构的科学家们通过研究共同完成了一项关于用于诊断和对前列腺癌进行评级的人工智能技术的全面国际验证,研究人员发现,AI系统或能与病理学家一样,识别并对来自不同国家的组织样本中的前列腺癌进行识别和分级,因此AI系统或许有望作为一种辅助工具引入到前列腺癌的诊断和治疗过程中去。
国际认证是通过一种名为PANDA的比赛来进行的,该比赛历时3个月,其能挑战1000多名AI专家所开发的用于对前列腺癌准确分级的系统。研究者Kimmo Kartasalo博士说道,比赛开始仅10天,研究人员就开发出了与普通病理学家相匹配的算法,而组织PANDA比赛或能揭示竞赛如何能够加速快速的创新过程,从而在AI的帮助下解决医疗保健中的具体问题。
当前前列腺癌诊断的一个问题在于,即使是针对相同的组织样本,不同的病理学家也会得出不同的结论,这意味着疗法决策是基于不确定的信息而制定的;研究者认为,利用AI技术或许在提高重现性方面有着非常大的潜力,也就是说,无论哪个病理学家进行评估,都能提高组织样本评估的一致性,从而就会导致更为准确的疗法选择。研究人员在早期研究中发现,AI系统能指示是否组织样本中包含癌症,同时还能评估活检组织中肿瘤组织的数量,并对前列腺癌的严重程度进行分级,AI系统能与国际病理学家相媲美。然而,在医疗领域中实时AI技术的主要挑战在于,AI系统通常对用于训练系统的数据不同的数据高度敏感,因此在应用于其它医院和其它国家时可能就不会产生可靠和稳健的结果。
【15】Cell:利用人工智能为未来的冠状病毒变体做准备
Joseph M. Taft,Cédric R. Weber,Beichen Gao, et al. Deep Mutational Learning Predicts ACE2 Binding and Antibody Escape to Combinatorial Mutations in the SARS-CoV-2 Receptor Binding Domain. Cell,2022,doi:10.1016/j.cell.2022.08.024.
SARS-CoV-2正在不断地变异,每一种新的变体往往让世界措手不及。以去年11月出现的高度变异的奥密克戎(Omicron)为例,它要求卫生当局制定一种快速反应策略,尽管最初对一些重要问题没有答案:接种疫苗的人和以前被感染的人对这种新变体的保护程度如何?抗体疗法对这种病毒变体是否仍然有效?近日,一篇发表在国际杂志Cell上题为“Deep Mutational Learning Predicts ACE2 Binding and Antibody Escape to Combinatorial Mutations in the SARS-CoV-2 Receptor Binding Domain”的研究报告中,来自瑞士苏黎世联邦理工学院等机构的科学家们通过研究开发出了一种使用人工智能回答此类问题的方法,甚至有可能在新变体出现后立即实时回答。
为了建立他们的方法,Reddy和他的团队利用实验室实验产生了SARS-CoV-2刺突蛋白的一大批变体。他们没有产生活病毒或利用活病毒开展实验,相反,他们只产生了SARS-CoV-2刺突蛋白的一部分,因此没有实验室泄漏的危险。刺突蛋白与人体细胞表面上的ACE2蛋白相互作用以便这种病毒感染能够感染人体细胞,而来自疫苗接种、感染或抗体疗法的抗体通过阻断这一机制发挥作用。SARS-CoV-2变体的许多突变都发生在这个区域,这使得这种病毒能够躲避免疫系统并继续传播。
尽管这些作者分析的一大批变体只包括理论上可能存在的几十亿个变体---这在实验室环境中是不可能测试的---中的一小部分,但它确实包含一百万个这样的变体。这些变体带有不同的突变或突变组合。通过对这一百万个变体的进行高通量实验和DNA测序,这些作者确定了这些变体如何成功地与ACE2蛋白和现有抗体疗法相互作用。这可表明每种潜在变体能够多好地感染人类细胞,以及它们能够多好地逃避抗体。这些作者利用这些收集到的数据来训练机器学习模型,该模型能够识别复杂的模式,而且当只给出一种新变体的DNA序列时,可以准确地预测它是否能与ACE2结合进行感染并逃避中和抗体的影响。最终的机器学习模型如今可以用来对理论上可能存在的数百亿个变体进行这些预测,这些变体有的具有单一突变,有的具有组合突变,并且远远超过了实验室中测试的一百万个变体。(Bioon.com)
2022年终盘点正在进行,更多精彩盘点敬请期待!
- 上一篇
2022年终盘点:阿尔兹海默病研究领域重磅级成果!
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在人类阿尔兹海默病研究领域取得了多项重磅级研究成果,本文中,小编就对本年度科学家们在该研究领域取得的相关研究成果进行整理,分享给大家! 【1】Cell:小胶质细胞利用蛋白SYK清除大脑中的碎片 有助预防阿尔兹海默病等神经退行性疾病 Hannah Enne
- 下一篇
2022年终盘点:咖啡和茶对机体健康益处研究进展!
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们进行了大量研究来揭示咖啡和茶对机体健康的益处,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家! 【1】BMC Med:每天喝茶或咖啡或能降低机体死亡风险 Yanchun Chen,Yuan Zhang,Mengnan

