【盘点】2022年终盘点:2022年Nature期刊精华
2022年即将结束,在过去的一年里,Nature期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Nature:揭示肌肉组织再生壁龛中的衰老细胞会抑制肌肉再生
doi:10.1038/s41586-022-05535-x
在一项新的研究中,来自西班牙国家心血管病研究中心、加泰罗尼亚科研与高级研究所和庞培法布拉大学等研究机构的研究人员确定了受伤后不可避免地出现的受损细胞(衰老细胞)如何对组织再生产生负面影响,以及这种机制如何在老年时期积极运作,但令人惊讶的是在年轻时期也是如此。这种负面作用可以通过遗传手段和药物来克服,从而恢复干细胞的再生功能。相关研究结果于2022年12月21日在线发表在Nature期刊上,论文标题为“Senescence atlas reveals an aged-like inflamed niche that blunts muscle regeneration”。
论文通讯作者、Pura Muñoz-Cánoves博士和Eusebio Perdiguero博士在小鼠实验中发现,衰老细胞是肌肉组织再生壁龛(muscle tissue regenerating niche,也译为肌肉组织再生微环境)的新调节成分,在生命的各个阶段都会阻碍肌肉再生。
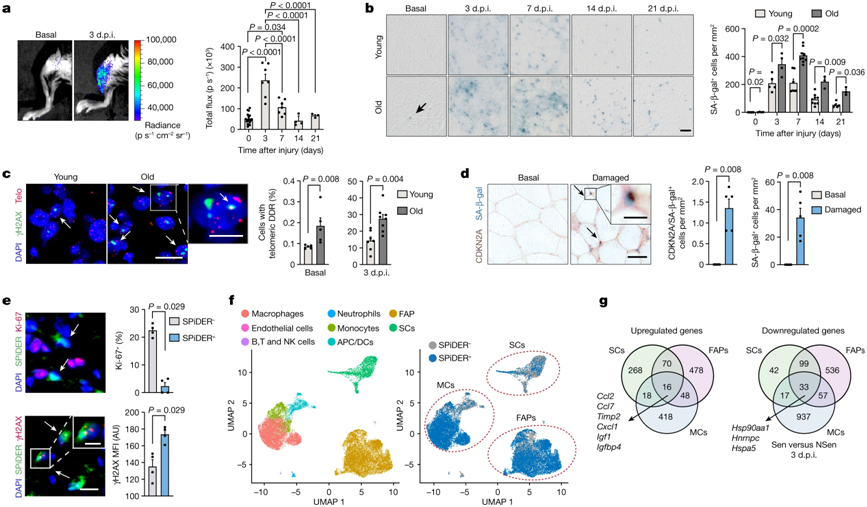
年轻小鼠和年老小鼠再生肌肉中的衰老细胞。图片来自Nature, 2022, doi:10.1038/s41586-022-05535-x。
在这项新的研究中,这些作者生成了首个不同年龄段的小鼠受损骨骼肌的衰老细胞的转录组图谱。他们发现,衰老细胞具有广泛的异质性,但它们显示出共同的特征,包括分泌促炎性因子和促纤维化因子。这种分泌反过来影响附近的干细胞,阻碍它们的再生能力,从而损害肌肉再生。
这些研究结果显示,减少衰老细胞载量(通过诱导这些细胞死亡的遗传手段或药物治疗)改善了老年肌肉的再生,而且出乎意料的是也改善了年轻肌肉的再生。年轻组织中的这些益处是由于减少了干细胞附近环境的炎症,从而促进了干细胞的功能。
2. Nature:一种特殊的“细胞胶水”或能再生机体组织、促进伤口愈合并再生机体神经组织
doi:10.1038/s41586-022-05622-z
细胞粘附分子在多细胞有机体中无处不在,其在组织发育、免疫细胞转运和神经系统布线等多种不同过程中能够指定精确的细胞-细胞间的相互作用。近日,一篇发表在国际杂志Nature上题为“Programming Multicellular Assembly with Synthetic Cell Adhesion Molecules”的研究报告中,来自加州大学旧金山分校等机构的科学家们通过研究开发出了一种类似于“细胞胶水”样的分子,其或能以精确的方式来指导细胞彼此结合在一起的方式,这一研究发现代表着科学家们向构建组织和器官迈出了一大步,同时也是科学家们在再生医学领域长期追求的目标。
这项研究中,研究人员设计出了含有定制粘附分子的工程化细胞,这些粘附分子能以一种可预测的方式与特定的伴侣细胞结合,从而形成复杂的多细胞组合。研究者Wendell Lim说道,我们能够以一种特殊的方式来工程化改造细胞,这种方式能促使我们控制与哪些细胞发生相互作用,以及这些相互作用的性质,这或许就为构建诸如组织和器官等新兴结构打开了一扇大门。机体的组织和器官在胎儿处于母体子宫内就开始形成了,并会持续发育到整个童年期,到了成年时期,很多引导这些产生过程的分子指令就会消失,诸如神经等组织不能从损伤或疾病中痊愈。
研究者Lim希望能通过工程化改造成体细胞来制造新的连接,从而克服这一问题,但要做到这一点,需要有能力来精确地涉及细胞之间的相互作用方式;一个组织的特性(诸如机体的皮肤)在很大程度上是由子内部不同的细胞的组织方式所决定的,如今我们正在设计方法来控制细胞的组织方式,这是我们合成拥有我们希望的特性的组织的核心。能让一个既定的组织变得不同的大部分原因就是其细胞如何紧密地结合在一起,在一个实体器官中(比如肺部或肝脏),很多细胞都会被紧密结合在一起,但在免疫系统中,较多的结合力会促使细胞能通过血管流动或在皮肤或器官组织的紧密结合的细胞之间爬行,从而抵达病原体或伤口患处。
为了指导细胞结合的质量,研究人员将其设计的粘附分子分为两部分,其中该分子的一部分能作为细胞外部的受体,并决定其能相互作用的其它细胞,而细胞内的另一部分则能调整行程的粘合强度,这两部分都以模块化的方式混合和匹配,从而就会形成一系列定制化的细胞,并以不同的方式与多种细胞类型进行结合。研究者Stevens表示,这些研究发现也有着其它应用,比如,研究人员能设计出特殊的组织来模拟疾病状态,从而使其能更容易地在人体组织中进行研究。
3. Nature:浙大科学家利用源自植物的纳米类囊体单元改善动物细胞合成代谢,有望减缓进展性疾病进展
doi:10.1038/s41586-022-05499-y
在一项新的研究中,来自中国浙江大学医学院的一个研究团队开发出一种方法,在治疗小鼠的骨关节炎时使用来自植物的光合细胞。相关研究结果发表在2022年12月15日的Nature期刊上,论文标题为“A plant-derived natural photosynthetic system for improving cell anabolism”。
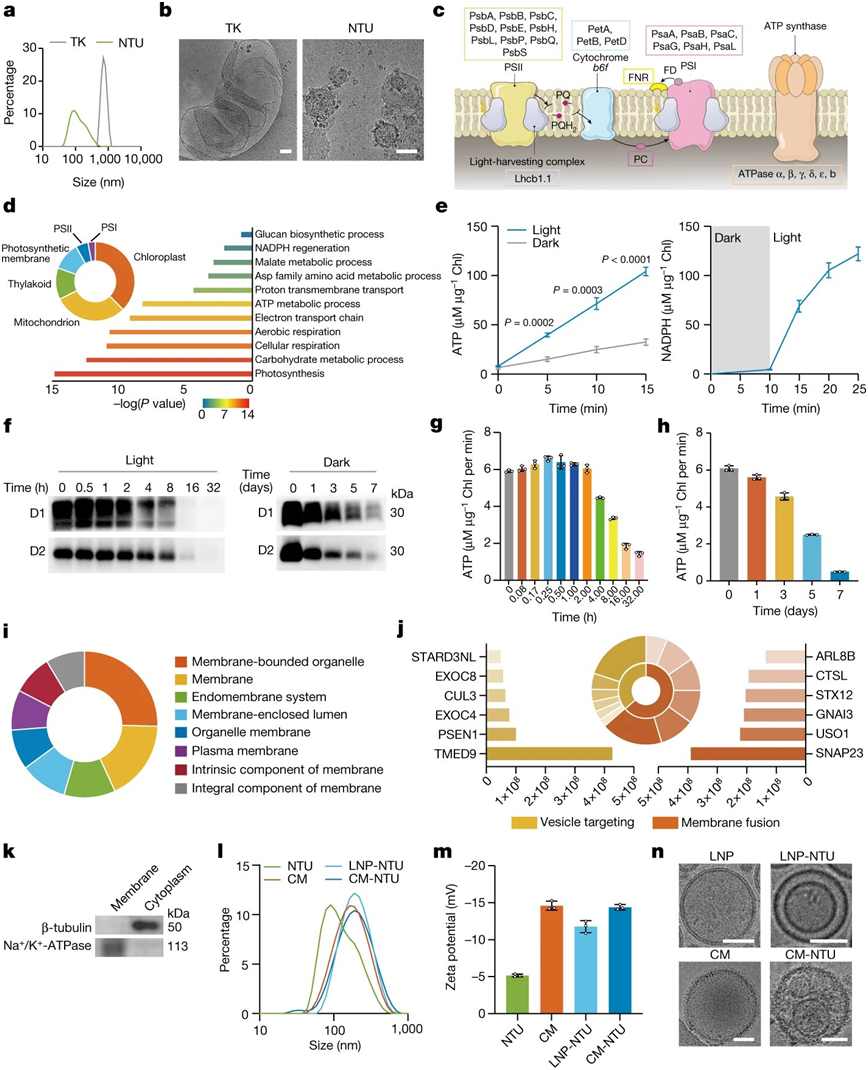
制备和表征软骨细胞膜-纳米类囊体单元。图片来自Nature, 2022, doi:10.1038/s41586-022-05499-y。
在这篇论文中,该团队描述了他们如何在植物中构建出纳米级的类囊体结构,即纳米类囊体单元(nanothylakoid unit),并将它们递送到动物细胞中,作为减缓或阻止疾病进展的一种方式。作为该团队的两名成员,Pengfei Chen和Xianfeng Lin也在同期Nature期刊上发表了一篇标题为“Plant-cell machinery for making metabolites transferred to mammalian cells”的研究简报形式的文章,概述了他们的研究工作。
该团队利用植物叶绿体构建出称为纳米类囊体单元的结构。他们随后用小鼠细胞覆盖它们,以防止当纳米类囊体单元被注射到患有骨关节炎的小鼠膝关节时,小鼠免疫系统对它们进行攻击。接下来,他们用灯光照射小鼠膝关节以激发光合作用过程,从而产生ATP和NADPH。他们的测试结果显示,该技术导致小鼠细胞的合成代谢得到改善,这反过来又导致受试小鼠的疾病进展减少(软骨退化放缓)。
该团队表示,他们的初步实验表明,他们的方法有希望成为治疗进展性疾病的一种新疗法。他们还指出,同样的方法可用于让细胞进行代谢,作为构建生物燃料和也许其他有用化学物质过程的一部分。
4. Nature:首次使用非病毒精确基因组编辑开发出的neoTCR-T细胞在临床试验中治疗实体癌并取得积极进展
doi:10.1038/s41586-022-05531-1
人类免疫系统在T细胞表面上有特定的受体,即T细胞受体(TCR),可以专门识别癌细胞并将它们与正常细胞区分开来。这些受体对每名患者来说都是不同的,因此找到一种有效的方法来分离它们并将它们导入到T细胞中,以产生一种个性化的T细胞疗法来治疗癌症,是使这种方法大规模可行的关键。在一项新的研究中,来自美国加州大学洛杉矶分校和PACT制药公司的研究人员首次使用CRISPR技术将外源基因导入到称为T细胞的免疫细胞中,使得这些经过基因改造的T细胞集中攻击癌细胞,潜在地让正常细胞不受伤害,从而提高免疫疗法的有效性。相关研究结果于2022年11月10日在线发表在Nature期刊上。
CRISPR技术以前曾被用于人体中去除特定的基因,使免疫系统能够更有效地对抗癌症。在这项新的研究中,这些作者开发了一种基于CRISPR/Cas9非病毒精确基因组编辑的临床级方法,同时敲除T细胞中的两个内源性TCR基因:TCRα(TRAC)和TCRβ(TRBC),并在TRAC基因座上插入新抗原特异性TCR(neoantigen-specific TCR, neoTCR)的两条链,所使用的neoTCR是从患者自身的循环T细胞中分离出来的,由此获得的T细胞称为neoTCR-T细胞。
16名难治性实体癌(包括结肠癌、乳腺癌和肺癌)患者首次在neoTCR-T细胞剂量递增的1期临床试验(NCT03970382)中接受了多达三种不同的neoTCR-T细胞输注,每种neoTCR-T细胞都表达了患者特异性的neoTCR。一名患者出现了1级细胞因子释放综合征,一名患者出现了3级脑炎。在接受neoTCR-T细胞输注前,所有患者都接受清除淋巴细胞的化疗,并且在化疗后出现预期的副作用。在接受neoTCR-T细胞输注后,5名患者病情稳定,其他11名患者出现疾病进展。在接受neoTCR-T细胞治疗后的肿瘤活组织中检测到neoTCR-T细胞,其频率高于治疗前表达内源性TCR的T细胞。
5. Nature:重大进展!在阿尔茨海默病中,蛋白medin与β淀粉样蛋白相互作用并共同沉积在大脑血管中
doi:10.1038/s41586-022-05440-3
蛋白medin与β淀粉样蛋白(Aβ)一起沉积在阿尔茨海默病患者的大脑血管中。在一项新的研究中,来自德国神经退行性疾病研究中心和图宾根大学等研究机构的研究人员发现了这种所谓的共同聚集现象。相关研究结果于2022年11月16日在线发表在Nature期刊上。
研究者表示,medin已被认识了20多年,但它对疾病的影响以前被低估了。我们能够发现阿尔茨海默病患者血管中的病理变化被medin明显加强。”蛋白medin属于淀粉样蛋白。在这类蛋白中,Aβ最为著名,因为它在阿尔茨海默病患者的大脑中凝结成团。这些聚集物随后既作为所谓的斑块直接沉积在脑组织中,也沉积在它的血管中,从而分别损害了神经细胞和血管。但是,尽管许多研究都集中在Aβ上,medin却没有成为关注的焦点。
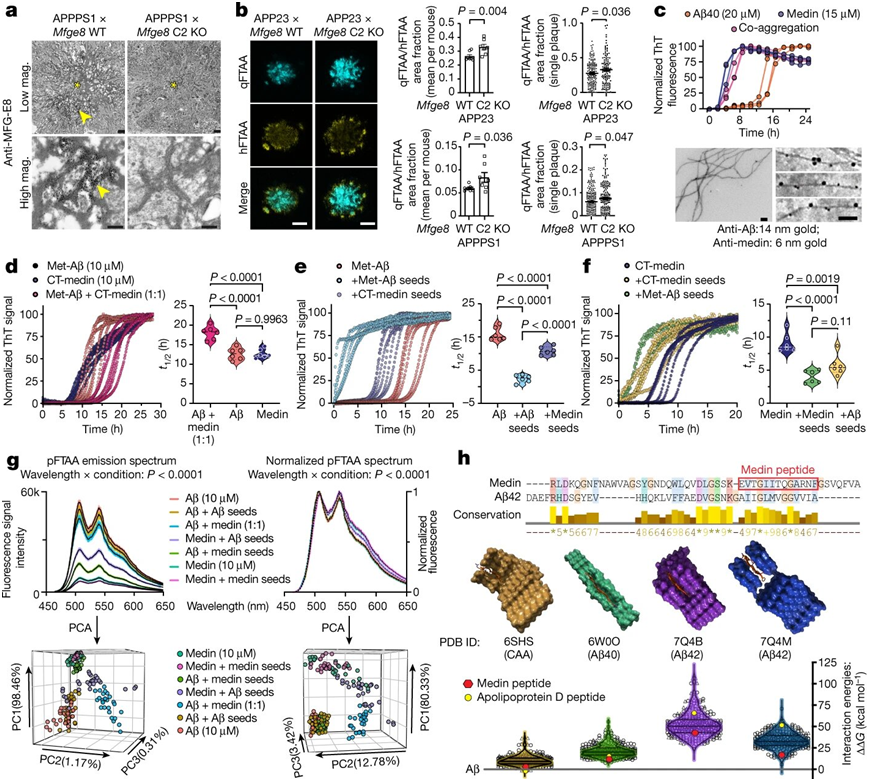
蛋白medin直接与β淀粉样蛋白相互作用,促进它的聚集。图片来自Nature, 2022, doi:10.1038/s41586-022-05440-3。
Neher解释说,“几乎没有病理学的证据---与medin相关的临床上引人注目的发现,而这往往是对一种淀粉样蛋白进行更深入研究的先决条件。”然而,medin实际上存在于几乎所有50岁以上的人的血管中,使得它成为已知最常见的淀粉样蛋白。Neher和他的团队最初发现medin甚至会在衰老的小鼠中产生,并且在两年前在PNAS期刊上报告了这一发现(PNAS, 2020, doi:10.1073/pnas.2011133117)。
小鼠的年龄越大,大脑血管中积累的medin越多,这是当时的发现。更重要的是,当大脑变得活跃并触发血液供应增加时,存在medin沉积的血管比没有medin的血管扩张得更慢。然而,血管的扩张能力对于以最佳方式向大脑供应氧气和营养物非常重要。
6. Nature:新研究揭示STING诱导的调节性B细胞破坏NK细胞的功能,有望开发出更有效的癌症免疫疗法
doi:10.1038/s41586-022-05254-3
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员发现了一种潜在的方法来克服阻断有效抗癌免疫反应的障碍,从而为在人体内进行更有效的免疫治疗提供了可能性。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“STING-induced regulatory B cells compromise NK function in cancer immunity”。
肿瘤细胞周围不利的免疫环境是使用免疫疗法治疗许多实体瘤的主要障碍,特别是胰腺癌和乳腺癌,因为这种抑制性的环境可以阻止有助于攻击肿瘤的免疫反应。一种称为STING(STimulator of INterferon Genes)的蛋白有希望有力地触发免疫系统的多个部分并破坏业已建立的障碍。研究者Jenny PY Ting博士说,“尽管激活免疫系统来控制恶性肿瘤已引发了癌症治疗变革,但有相当一部分患者对免疫疗法没有反应。然而,靶向STING的新药物一直是医药开发的重中之重,然而临床试验显示,肿瘤对靶向STING的药物有明显的抵抗性。”
Ting说,“在临床上,为了提高STING靶向药物的有效性,我们需要更深入地了解这些药物如何影响肿瘤中的不同免疫细胞,因为STING对免疫的有益作用可能会被它的意料之外的免疫抑制作用所抵消。”这些作者主要关注胰腺癌的临床前模型,因为这种疾病的五年生存率只有10%,而且没有什么治疗方案。他们还将这项新的研究扩展到其他实体瘤,包括黑色素瘤、三阴性乳腺癌和肺癌。重要的是,他们在胰腺癌中观察到的情况广泛适用于这些其他癌症。
7. Nature:首次解析出IgM型B细胞抗原受体的三维结构图
doi:10.1038/s41586-022-05412-7
B细胞的表面覆盖着抗原受体,它们用这些受体识别入侵的病原体,如细菌和病毒。当B细胞抗原受体与外来抗原结合时,B细胞被激活并触发抗体的产生。抗体对我们的生存至关重要,并保护我们免受SARS-CoV-2等病原体感染引起的严重疾病。疫苗接种具有保护作用,因为它们激活了抗原受体,从而引发了免疫反应。在一项新的研究中,来自来自德国弗莱堡大学、美国哈佛医学院和波士顿儿童医院的研究人员公布了IgM型B细胞抗原受体的确切分子结构。他们的发现表明,B细胞表面的IgM型受体与其他受体相互作用,从而控制其信号转导。相关研究结果于2022年10月13日在线发表在Nature期刊上,论文标题为“Structural principles of B-cell antigen receptor assembly”。
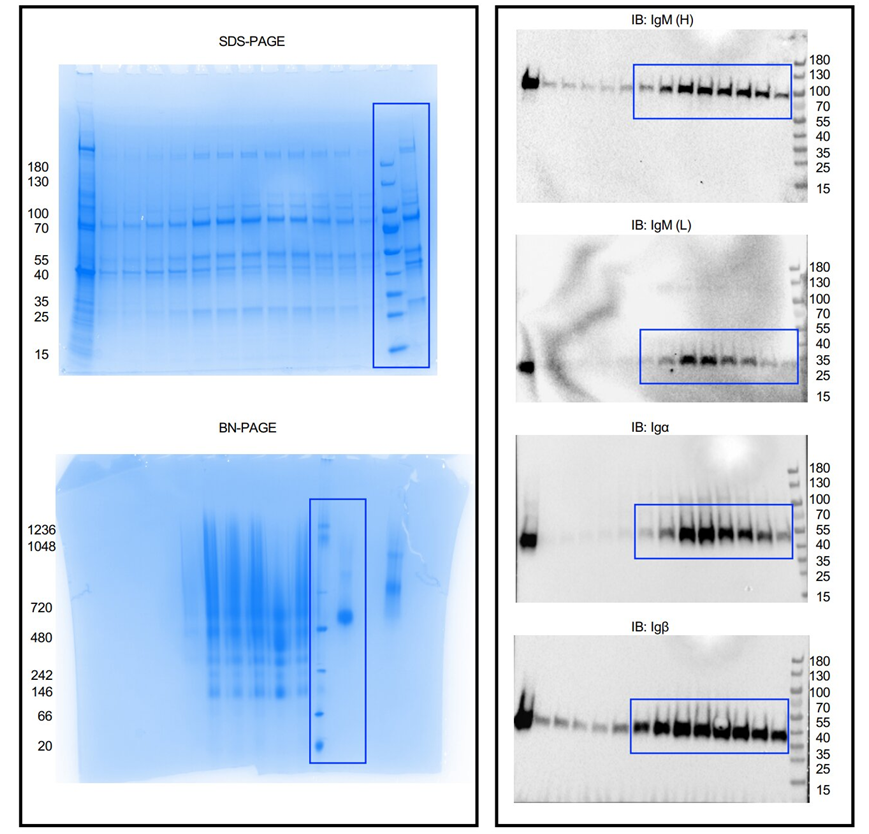
未经裁剪的SDS-PAGE凝胶和免疫印迹。图片来自Nature, 2022, doi:10.1038/s41586-022-05412-7。
B细胞抗原受体由一个结合在细胞膜上的免疫球蛋白(即膜结合抗体)和两个较小的亚基Igα和Igβ组成。一旦B细胞抗原受体识别出病原体,这些较小的亚基就会将信号传导到细胞内部,因而也称为信号传导亚基。论文共同通讯作者、弗莱堡大学生物系的Michael Reth教授说,“这些信号传导亚基究竟是如何与免疫球蛋白连接在一起的,这在以前是未知的。”Reth教授30多年来一直在研究B细胞抗原受体,并且最初发现了它的信号传导亚基。Reth说,“长期以来,我们没有技术上的可能性来研究膜蛋白的确切结构。如今,低温电子显微镜使我们能够解析出高分辨率的B细胞抗原受体的结构图。”
在低温电镜中,待研究的蛋白分子被非常迅速地冷却到零下183℃。这减少了它们的自然运动,防止了会破坏蛋白结构的微小冰晶形成。通过这种方式,有可能实现比其他电子显微镜方法高许多倍的分辨率。
8. Nature:基于RNA的新型编辑工具CellREADR可精确编辑任何类型的细胞
doi:10.1038/s41586-022-05280-1
在一项新的研究中,来自美国杜克大学和冷泉港实验室的研究人员开发出一种基于RNA的编辑工具,它针对的是单个细胞,而不是基因。它能够精确靶向任何类型的细胞,并有选择地添加任何感兴趣的蛋白。该工具可能能够通过修改非常特定的细胞和细胞功能来控制疾病。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“Programmable RNA sensing for cell monitoring and manipulation”。
在论文通讯作者、杜克大学神经生物学者Z. Josh Huang博士和论文第一作者、杜克大学博士后研究员Yongjun Qian博士的领导下,这些作者使用一种基于RNA的探针,证实他们可以在细胞中引入荧光标签,以标记特定类型的脑组织;一种光敏的开启/关闭开关,以沉默或激活他们选择的神经元;甚至一种自我摧毁酶,以精确清除一些细胞而不是其他细胞。
他们的选择性细胞监测和控制系统依赖于ADAR酶,这种酶存在于每种动物的细胞中。Huang说,虽然CellREADR(Cell access through RNA sensing by Endogenous ADAR,通过内源性ADAR的RNA传感进行细胞访问)还处于早期阶段,但是潜在的应用似乎是无止境的,它有可能在整个动物界发挥作用。Huang说,“我们很兴奋,因为这提供了一种简化的、可扩展的和可普及的技术,以监测和操纵任何动物的所有细胞类型。我们实际上可以修改特定类型的细胞功能来控制疾病,而不考虑它们最初的遗传易感性。这在目前的治疗方法或药物中是不可能的。”
9. Nature:重大进展!揭示免疫细胞ILC3在协助免疫系统对肠道益生菌产生耐受性中起着重要作用
doi:10.1038/s41586-022-05141-x
在一项新的研究中,来自美国威尔康奈尔医学院等研究机构的研究人员发现一群称为3型天然淋巴细胞(group 3 innate lymphoid cell, ILC3)的免疫细胞在建立对定居在人类胃肠道中的共生微生物的耐受性方面发挥着重要作用。这一发现阐明了肠道健康和粘膜免疫的一个重要方面---这可能是更好地治疗炎症性肠病(IBD)、结肠癌和其它慢性疾病的关键。相关研究结果于2022年9月7日在线发表在Nature期刊上。
研究者Gregory F. Sonnenberg说,“作为这项新研究的一部分,我们确定了一条驱动对胃肠道微生物群的免疫耐受的新途径。这是我们对粘膜免疫力理解的一个根本性进展,可能是理解免疫系统在IBD等疾病中开始不适当地攻击微生物群时出问题的关键。”科学家们早就知道,数万亿个细菌、真菌和其他微生物共生在哺乳动物的肠道中。免疫系统通常耐受这些“有益的”肠道微生物,而不是攻击它们,其机制还没有得到很好的理解。但有证据表明,这种耐受性在IBD中受到破坏,导致有害的肠道炎症爆发。因此,对肠道免疫耐受性的详细了解可能使开发强大的IBD新疗法成为可能。IBD包括克罗恩病和溃疡性结肠炎,仅在美国就影响了几百万人。
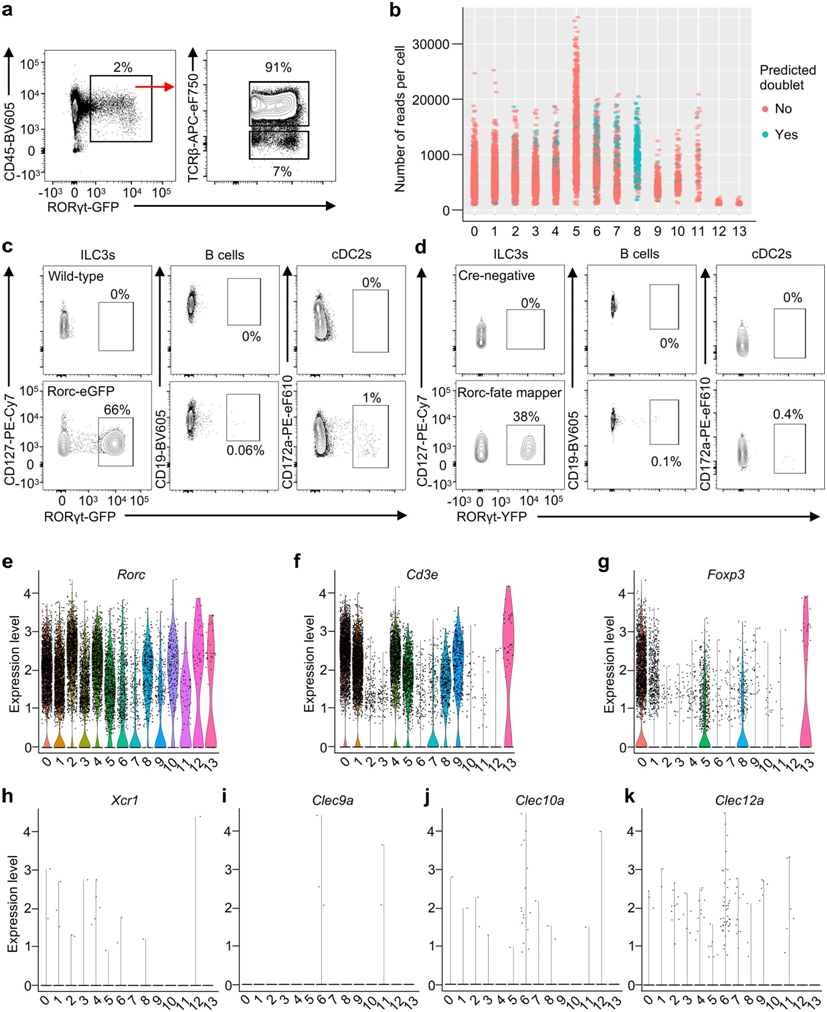
小鼠mLN RORγt+细胞的scRNA-seq分析。图片来自Nature, 2022, doi:10.1038/s41586-022-05141-x。
在这项新的研究中,Sonnenberg及其同事们使用单细胞测序和荧光成像技术来描述排出健康小鼠肠道的肠系膜淋巴结中的免疫细胞。他们专注于表达转录因子RORγt的免疫细胞,这些免疫细胞已知会在对肠道内定植的微生物作出反应时驱动炎症或耐受。他们发现,这些组织中主要的免疫细胞类型是T细胞和ILC3。后者是一个免疫细胞家族,在肠道和肺部等粘膜组织中作为第一道防线发挥作用。通过与英国伯明翰大学的研究人员密切合作,Sonnenberg及其研究团队观察到,在称为滤泡间区(interfollicular zone)的淋巴结区域,ILC3与一种特定类型的T细胞---称为RORγt+调节性T细胞(Treg)---密切相互作用,从而适应于抑制炎症和免疫活动,以促进肠道中的耐受性。
10. Nature:重大进展!一种缓慢给送、剂量递增的疫苗接种策略有望让身体产生强效中和HIV的抗体
doi:10.1038/s41586-022-05216-9
在一项新的研究中,来自美国拉霍亚免疫学研究所、斯克里普斯研究所和加州大学圣地亚哥分校等研究机构的研究人员发现了免疫系统如何能够转变为一种抗体制造机器,能够中和目前最难以捉摸的病毒之一:HIV。相关研究结果于2022年9月21日在线发表在Nature期刊上。
科学家们曾经认为,制造抗体的B细胞只花了几周时间来完善它们对付病毒威胁的武器装备。如今,这项新的研究表明,一种“缓慢给送、剂量递增”的疫苗接种策略可以促使B细胞花几个月的时间来突变和进化它们对抗病原体的抗体。这一发现是朝着开发有效、持久的疫苗来对抗病原体(如HIV、流感病毒、疟原虫和SARS-CoV-2)迈出的重要一步。研究者Shane Crotty博士说,“这表明,如果你给它机会,免疫系统可以做真正非凡的事情---就某些疫苗而言,耐心真的是一种美德。”
大多数病原体对免疫系统来说是陌生的。它们是不受欢迎的访客,身上覆盖着陌生的蛋白。当身体的树突细胞看到这些奇怪的蛋白时,它们向“辅助性”T细胞发出信号,开始训练免疫细胞军队。B细胞得到了入侵者接近的信号,它们显示出来自该入侵者的分子标志物(称为抗原)。B细胞想要制造有效的抗体来中和入侵者,所以它们前往一个特殊的地方:生发中心。
生发中心是在整个身体的特殊“淋巴组织”中形成的微观结构。生发中心对于对抗病原体至关重要,因为它们给B细胞提供了一个突变和测试它们产生的抗体的地方。人们称生发中心是“抗体进化的引擎”。随着时间的推移,那些不能突变和改善它们产生的抗体的B细胞被淘汰了。产生有用突变的B细胞则被送入体内进行战争。
11. Nature:挑战常规!胚胎时期的造血祖细胞并不由造血干细胞产生
doi:10.1038/s41586-022-05203-0
造血干细胞(HSC)的自我更新和分化受到严格控制以维持成人骨髓中的HSC平衡。在胎儿发育过程中,HSC的扩增(自我更新)和分化的造血细胞的产生(分化)都是维持造血系统以便身体生长所必需的。然而,目前仍不清楚这两种看似对立的过程是如何在短暂的胚胎期内完成的。胎儿肝脏是胚胎阶段的主要造血器官。一般认为,胎儿肝脏的造血层次结构是通过胎儿HSC的分化建立的。这种观点认为,造血干细胞和后代祖细胞之间的关系从胚胎到成年时是保守的。
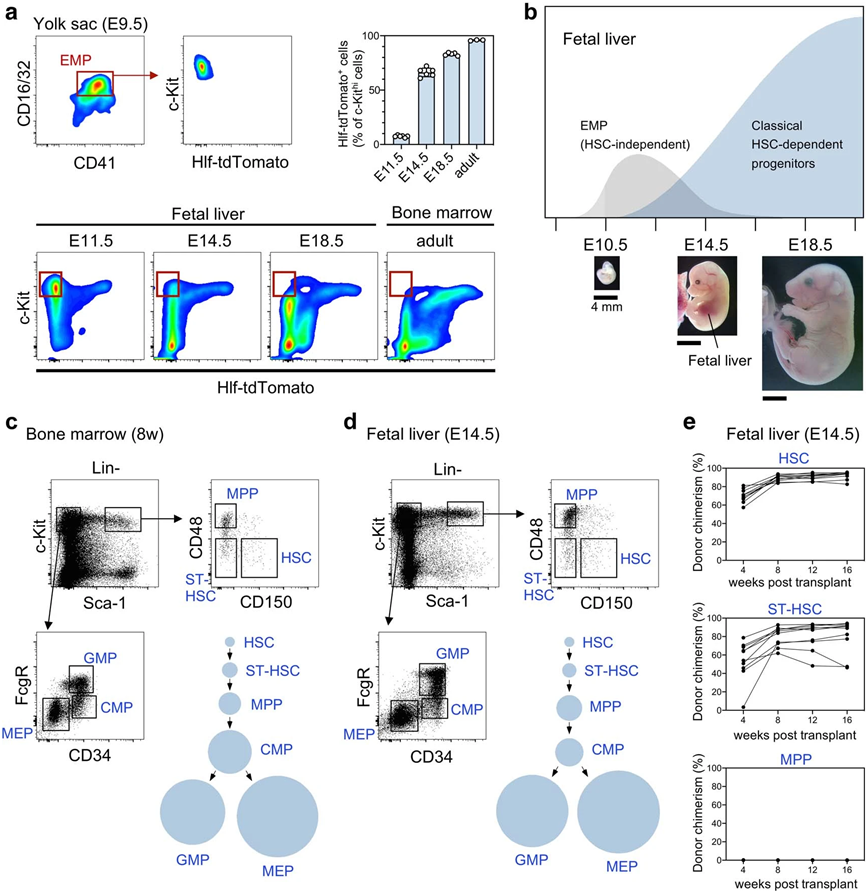
妊娠晚期胎儿肝脏中的造血干细胞和造血祖细胞。图片来自Nature, 2022, doi:10.1038/s41586-022-05203-0。
在一项新的研究中,来自日本熊本大学、东京女子医科大学、东京大学和新加坡国立大学等研究机构的研究人员利用谱系追踪和HSC缺失的突变小鼠发现在胎儿发育期间,大多数造血祖细胞是直接由HSC前体细胞而不是HSC产生的。此外,谱系追踪还显示,胎儿HSC在出生前对造血祖细胞的产生贡献最小。他们认为这些发现表明,胚胎中的大多数血细胞是不依赖HSC的,并促使人们重新考虑干细胞在胚胎体形成中的作用。相关研究结果发表在2022年9月22日的Nature期刊上。
关于造血系统的形成,这些作者还解决了一个长期存在的问题,即HSC的起源。以前的移植实验结合体外培养提出,造血干细胞主要产生于胚胎内的主动脉-性腺-中期肾(aorta-gonad-mesonephros, AGM)区域。然而,由于缺乏明确的分子和体内证据,这一发现一直存在争议。如今,这项新的研究首次发现转录因子Evi1在胚胎内动脉中特异性表达,并且是造血干细胞产生的必要条件和充分条件。
12. Nature:重大进展!新技术可以恢复死猪中的细胞和器官功能
doi:10.1038/s41586-022-05016-1
在最后一次心跳的几分钟内,由缺乏血流、氧气和营养物引发的一连串生物化学事件开始破坏身体中的细胞和器官。不过,在一项新的研究中,来自美国耶鲁大学的研究人员发现,大规模和永久性的细胞衰竭不一定会发生得这么快。利用他们开发的一项新技术,向器官和组织输送一种专门设计的细胞保护液,他们在猪死亡一小时后恢复了它们的血液循环和其他细胞功能。这些发现可能有助于在手术期间延长人类器官的健康,并扩大捐赠器官的可用性。相关研究结果于2022年8月3日在线发表在Nature期刊上。
论文共同第一作者、耶鲁大学医学院神经科学副研究员David Andrijevic说,“所有细胞都不会立即死亡,有一系列更持久的事件发生。这是一个你可以干预、停止并恢复一些细胞功能的过程。”研究者Sestan说,“如果我们能够在死亡的大脑---一种已知最容易受到缺血[血液供应不足]影响的器官---中恢复某些细胞功能,那么我们假设在其他重要的可移植器官中也能实现类似的功能。”
在这项新的研究中,这些作者---包括Sestan及其同事Andrijevic、Zvonimir Vrselja、Taras Lysyy和Shupei Zhang---将一种名为OrganEx的BrainEx改良版应用于整只猪。该技术包括一个类似于心肺机(在手术中承担心脏和肺部的工作)的灌注装置以及一种含有化合物的实验性液体,这些化合物可以促进细胞健康并抑制整个猪体的炎症。在麻醉的猪身上诱发了心脏骤停,在死后一小时用OrganEx处理。在使用OrganEx处理6小时后,这些作者发现,猪身体的许多部位---包括心脏、肝脏和肾脏---的某些关键细胞功能是活跃的,并且一些器官功能已经恢复。例如,他们在心脏中发现了电活动的证据,而且它保留了收缩的能力。Sestan说,“我们还能够恢复整个身体的血液循环,这让我们感到吃惊。”
13. Nature:重大进展!揭示较低温度抑制癌症生长机制,有助开发新的抗肿瘤疗法
doi:10.1038/s41586-022-05030-3
在一项针对小鼠的新研究中,来自瑞典卡罗琳学院等研究机构的研究人员发现调低自动调温器的温度似乎会使癌细胞更难生长。他们发现,寒冷的温度会激活产热的棕色脂肪,而激活后的棕色脂肪会消耗肿瘤茁壮成长所需的糖分。在一名暴露于较低室温下的癌症患者身上也发现了类似的代谢机制。相关研究结果于2022年8月3日在线发表在Nature期刊上。
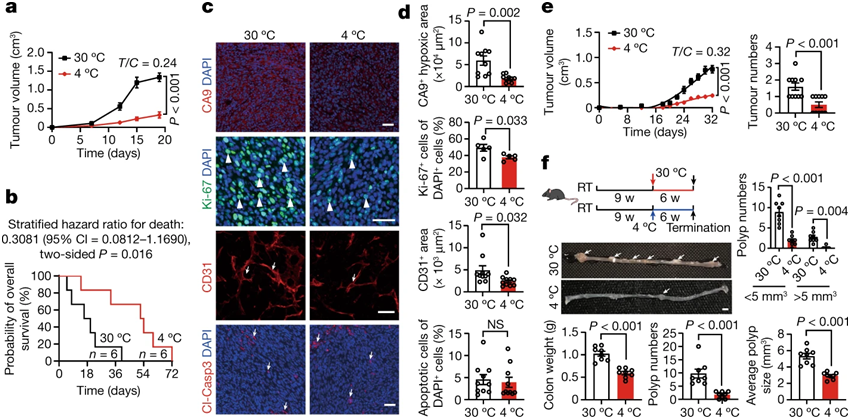
冷暴露抑制异种移植肿瘤和遗传自发肿瘤生长,延长荷瘤小鼠的总体生存和改变肿瘤微环境。图片来自Nature, 2022, doi:10.1038/s41586-022-05030-3。
研究者Yihai Cao教授说,“我们发现,寒冷激活的棕色脂肪组织与肿瘤竞争葡萄糖,并能帮助抑制小鼠体内的肿瘤生长。我们的研究结果表明,冷暴露(cold exposure)可能是一种有希望的癌症治疗新方法,尽管这需要在更大的临床研究中得到验证。”
这项新的研究比较了患有各种类型癌症(包括结肠直肠癌、乳腺癌和胰腺癌)的小鼠在暴露于寒冷与温暖的生活条件下的肿瘤生长和生存率。适应4℃温度的小鼠的肿瘤生长速度明显较慢,与生活在30℃房间的小鼠相比,它们的寿命几乎是后者的两倍。为了找出其中的原因,这些作者分析了组织中的标志物以研究细胞反应,并使用成像测试来检查葡萄糖代谢情况。癌细胞通常需要大量的葡萄糖来生长。他们发现,低温引发了棕色脂肪组织(也称为棕色脂肪)对葡萄糖的大量吸收,其中棕色脂肪是一种在寒冷条件下负责保持身体温暖的脂肪。与此同时,葡萄糖信号在肿瘤细胞中几乎检测不到。
14. Nature:间歇性禁食竟可促进神经损伤愈合
doi:10.1038/s41586-022-04884-x
在一项新的研究中,来自英国帝国理工学院的研究人员发现间歇性禁食改变了小鼠的肠道细菌活动,增加了它们从神经损伤中恢复的能力。相关研究结果于2022年6月22日在线发表在Nature期刊上,论文标题为“The gut metabolite indole-3 propionate promotes nerve regeneration and repair”。
这些作者观察到间歇性禁食如何导致肠道细菌增加一种称为3-吲哚丙酸(3-Indolepropionic acid, IPA)的代谢物的产生。这种代谢物是称为轴突的神经纤维再生所需要的,而轴突是神经细胞末端的线状结构,向身体的其他细胞发出电化学信号。
这种新的机制是在小鼠身上发现的,并希望在未来的任何人体临床试验中也能得到证实。这些作者表示产生IPA的肠道细菌,即产芽孢梭菌(Clostridium sporogenesis),在人类和小鼠的肠道中自然存在,而且IPA也存在于人类的血液中。
论文通讯作者、帝国理工学院脑科学系Simone Di Giovanni教授说,“目前除了手术重建之外,没有任何治疗神经损伤的方法,而手术重建只对一小部分病例有效,这促使我们研究生活方式的改变是否可以有助于恢复。其他研究之前已将间歇性禁食与伤口修复和新神经元的生长联系在一起---但我们的研究是第一项明确解释禁食如何有助于治愈神经损伤的研究。”
15. Nature:震惊!诺如病毒和轮状病毒等肠道病毒可通过唾液传播
doi:10.1038/s41586-022-04895-8
在一项新的研究中,来自美国国家卫生研究院(NIH)等研究机构的研究人员发现一类已知会导致严重腹泻疾病的肠道病毒可以在小鼠的唾液腺中生长,并通过其唾液传播。这一发现表明,这些常见的肠道病毒存在一种新的传播途径。这些肠道病毒每年困扰着全世界数十亿人,而且可能是致命的。相关研究结果于2022年6月29日在线发表在Nature期刊上,论文标题为“Enteric viruses replicate in salivary glands and infect through saliva”。
这些所谓的肠道病毒通过唾液传播表明,咳嗽、说话、打喷嚏、分享食物和餐具,甚至接吻都有可能传播这些病毒。这些新发现仍然需要在人类研究中得到证实。这些发现可能会带来更好的方法来预防、诊断和治疗由这些病毒引起的疾病,并有可能拯救生命。
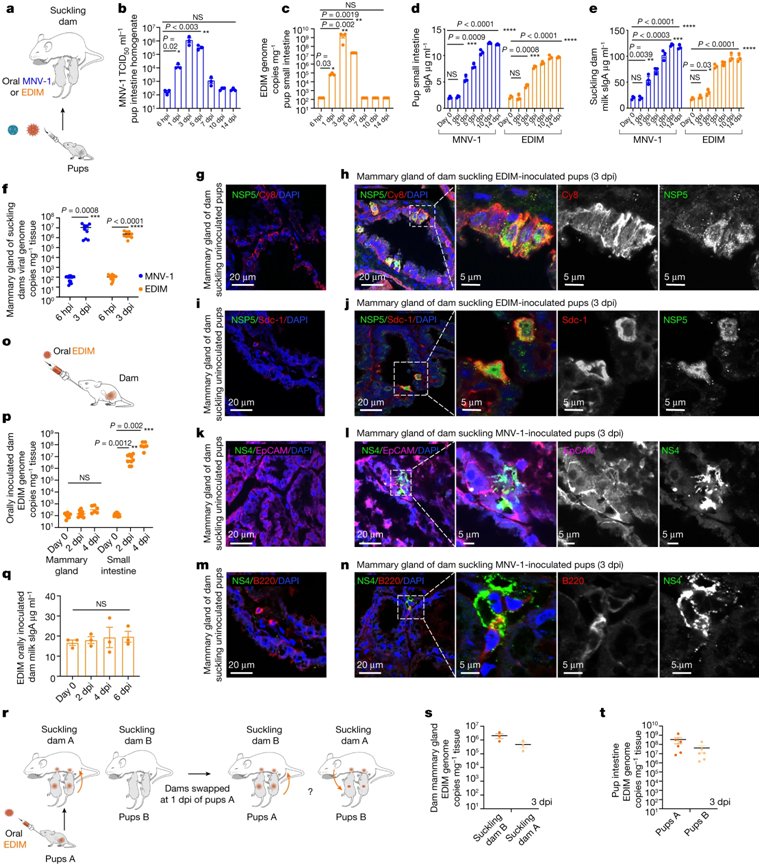
哺乳期受感染的幼崽通过吸吮乳汁直接将肠道病毒传染给母亲的乳腺。图片来自Nature, 2022, doi:10.1038/s41586-022-04895-8。
一段时间以来,科学家们已经知道,诸如诺如病毒和轮状病毒之类的肠道病毒可以通过摄入被含有这些病毒的粪便污染的食物或液体而传播。肠道病毒被认为会绕过唾液腺,以肠道为目标,随后通过粪便排出。尽管一些科学家怀疑可能存在另一种传播途径,但直到现在这一理论在很大程度上仍未得到验证。
如今,这些作者将需要证实肠道病毒的唾液传播在人类中是可能的。他们说,如果他们发现确实如此,他们还可能发现这种传播途径甚至比传统途径更常见。他们说,这样的发现可能有助于解释为什么全世界每年肠道病毒感染的数量如此之多,却未能充分说明粪便污染是唯一的传播途径。
16. Nature:重磅!破解人类卵母细胞在卵巢中休眠50年仍具生殖能力之谜
doi:10.1038/s41586-022-04979-5
在一项新的研究中,来自西班牙巴塞罗那科学技术研究所和庞培法布拉大学等研究机构的研究人员发现未成熟的人类卵细胞跳过了一种被认为是产生能量必不可少的基本代谢反应。相关研究结果于2022年7月20日在线发表在Nature期刊上。
通过改变代谢活动,未成熟的人类卵细胞可以避免产生有害的活性氧分子,这些分子可以累积起来,损害DNA并导致细胞死亡。这些发现解释了人类卵细胞如何在卵巢中保持长达50年的休眠状态而不丧失其生殖能力。
论文第一作者、巴塞罗那科学技术研究所基因组调节中心博士后研究员Aida Rodriguez博士说,“人类在出生时就拥有了一生中所有的卵细胞供应。由于人类也是最长寿的陆生哺乳动物,卵细胞必须保持原始状态,同时避免几十年的磨损。我们表明,这个问题是通过跳过一种基本的代谢反应来解决的,这种代谢反应也是细胞损伤的主要来源。作为一种长期维护策略,它就像把电池置于待机模式。这代表了一种在动物细胞中从未见过的全新模式。”
在胎儿发育过程中,人类卵细胞(也称为卵子)首先在卵巢中形成,经历了不同的成熟阶段。在这个过程的早期阶段,被称为卵母细胞(oocyte)的未成熟卵细胞进入细胞停滞期,在卵巢中保持长达50年的休眠状态。像所有其他真核细胞一样,卵母细胞有线粒体---细胞的能量工厂---它们在这段休眠期利用线粒体来产生能量以满足其需求。
17. Nature:我国科学家揭示糖尿病跨代传播新机制
doi:10.1038/s41586-022-04756-4
对症治疗是过去治疗慢性病的一种常见方法。例如,糖尿病的治疗是通过控制葡萄糖的增加和用胰岛素缓解多种由糖尿病引起的并发症。然而,如何预防糖尿病在科学界和医学界仍然是一个谜,发现这种疾病的起源以进行早期干预已成为全球研究热点。
在一项新的研究中,中国浙江大学医学院附属妇产科医院的黄荷凤(Huang Hefeng)教授课题组和中国科学院分子细胞科学卓越创新中心徐国良(Xu Guoliang)教授课题组发现了糖尿病代际传播的新机制。他们的研究表明,在卵母细胞发育过程中存在一个对环境敏感的窗口,它赋予下一代葡萄糖耐受不良的易感性。相关研究结果发表在2022年5月26日的Nature期刊上。
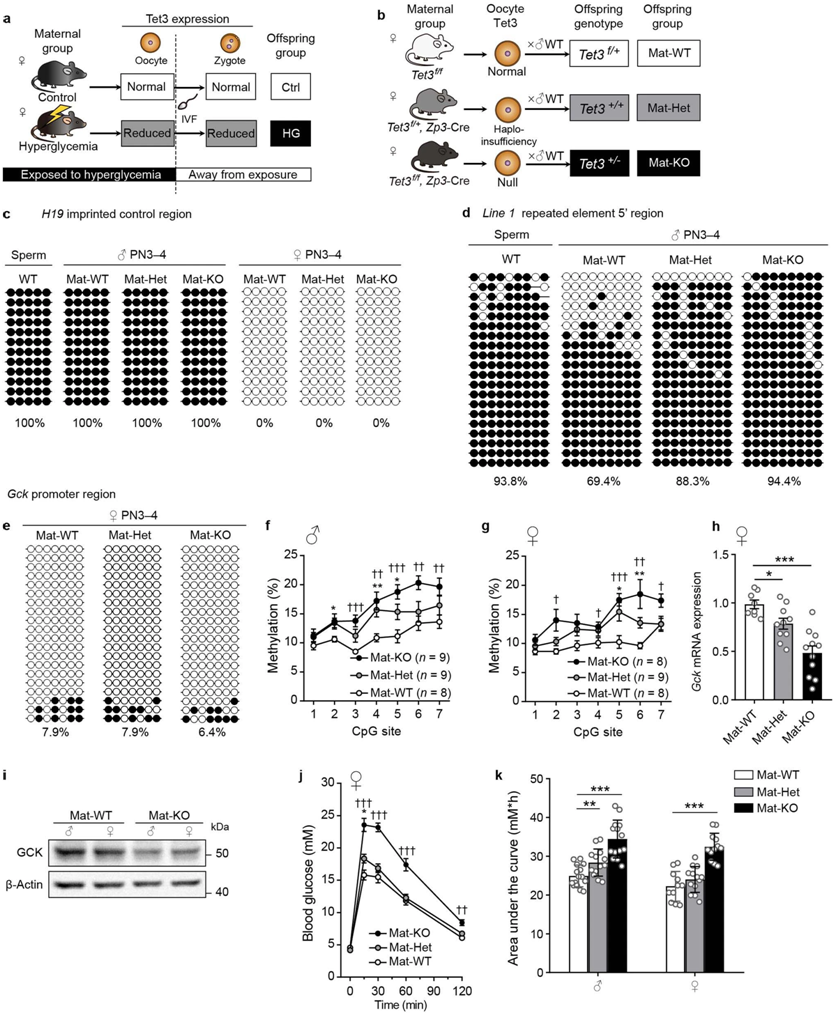
在卵母细胞特异性Tet3条件基因敲除母鼠中,Line 15区域和Gck启动子的甲基化水平增加,葡萄糖耐量受损,图片来自Nature, 2022, doi:10.1038/s41586-022-04756-4。
作为一位知名的妇产科医生,黄教授对母体对其后代的潜在影响很感兴趣。为此,她带领她的课题组对不良的母体环境因素引起的成年后代的疾病进行了研究。他们发现暴露于高葡萄糖/雄激素可以通过改变子宫内胚胎/胎儿的DNA甲基化图谱或影响精子/卵子的表观遗传学修饰而引发慢性疾病的代际或跨代遗传。黄教授已从临床调查和动物模型中得出结论,糖尿病和高血压等慢性疾病可能是由发育引起的,因此率先报告了“通过配子进行表观遗传”的假说。然而,这一假说仍未得到验证。
为了证实这一假说,黄教授课题组开始关注以下问题:孕前的母体环境因素是否影响后代的健康?母体高血糖是否会通过卵母细胞增加慢性疾病的风险?为了解决这些问题,这些作者建立了一种雌性高血糖小鼠模型。为了排除高血糖对胚胎和胎儿发育的持续影响,他们巧妙地取出受影响的卵母细胞进行体外受精,并将胚胎移植到健康的寄养小鼠身上以产生后代。代谢测量显示它们的后代表现出葡萄糖耐量受损,表明受不良高血糖环境影响的卵母细胞增加了对慢性疾病的易感性。因此,这一发现支持了黄教授的假说。
18. Nature:重磅!发现血细胞的另一种重要起源----胚胎多能祖细胞
doi:10.1038/s41586-022-04804-z
我们血液的起源可能和我们想象的不太一样。在一项新的突破性研究中,来自波士顿儿童医院和哈佛大学的研究人员利用小鼠的细胞“条形码”,发现血细胞有两种起源而不是一种,这可能对血癌、骨髓移植和免疫学产生影响。相关研究结果于2022年6月15日在线发表在Nature期刊上。
Camargo说,“历史上,人们一直认为我们的大部分血液来自于极少数的细胞,这些细胞最终成为造血干细胞。我们惊讶地发现了另一组不来自干细胞的祖细胞。它们在胎儿时期制造了大部分的血液,直到成年初期,然后逐渐开始减少。”这些作者如今正在继续研究,看看这些发现是否也适用于人类。如果是这样,这组称为胚胎多能祖细胞(embryonic multipotent progenitor cell, eMPP)的祖细胞有可能为增强老龄人免疫系统的新疗法提供参考。它们还可能为血癌(尤其是儿童的血癌)提供新的线索,并有助于使骨髓移植更加有效。
Camargo团队应用了他们几年前开发的一种条形码技术,并在Cell期刊上进行了记载(Cell, 2020, doi:10.1016/j.cell.2020.04.048)。他们使用转座酶或CRISPR基因编辑,将独特的基因序列插入小鼠胚胎细胞中,使它们的所有后代细胞也携带这些序列。这使得他们能够追踪所有不同类型的血细胞的出现以及它们从哪里来,一直到成年期。Camargo说,“以前,人们没有这些工具。此外,干细胞产生所有血细胞的想法在这个领域是如此根深蒂固,以至于没有人试图质疑它。通过追踪小鼠身上发生的事情,我们能够看到新的生物学知识。”
19. Nature:揭示人类疱疹病毒通过抑制宿主细胞microRNA产生而重新激活机制
doi:10.1038/s41586-022-04667-4
迄今为止,人类已知有八种不同的疱疹病毒。它们在急性感染后都会永久地在体内定居。在某些情况下,它们会从这个休眠阶段苏醒过来,增殖并攻击其他细胞。这种重新激活往往与瘙痒性唇疱疹或带状疱疹等症状有关。
在进化过程中,大多数疱疹病毒学会了利用小RNA分子,也就是所谓的microRNA,对宿主细胞重编程,使之有利于自己。在一项新的研究中,德国维尔茨堡大学的Bhupesh Prusty和Lars Dolken领导的一个研究团队能够首次证实一种疱疹病毒microRNA作为主调节因子诱导这种病毒的重新激活。他们提出了人类疱疹病毒6(human herpesvirus 6, HHV-6)引发自身重新激活的一种以前未知的细胞机制。相关研究结果发表在2022年5月19日的Nature期刊上,论文标题为“Selective inhibition of miRNA processing by a herpesvirus-encoded miRNA”。
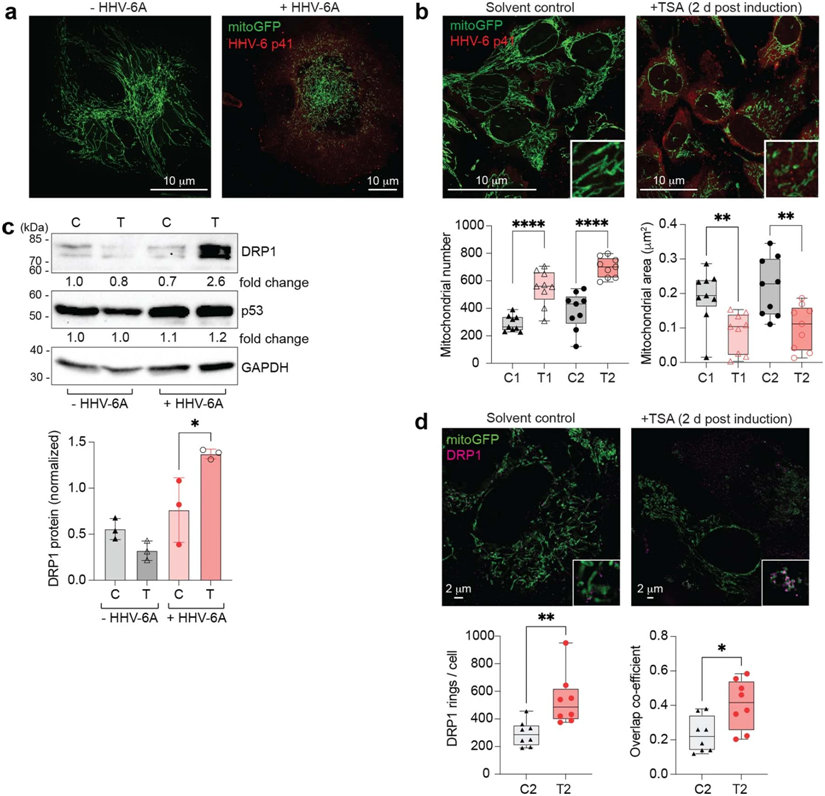
HHV-6A重新激活通过p53/DRP1轴诱导线粒体裂殖。图片来自Nature, 2022, doi:10.1038/s41586-022-04667-4。
90%以上的人都感染了HHV-6而没有注意到。该病毒可能只有在反复苏醒时才会引起问题。HHV-6重新激活据猜测会损害心脏功能,引起移植器官的排斥反应,并引发多发性硬化症或慢性疲劳综合症等疾病。此外,近期的研究已提示着这种疱疹病毒可能参与了精神分裂症、双相情感障碍和其他神经系统疾病的产生。Dolken说,“疱疹病毒如何从休眠状态重新激活是疱疹病毒研究的核心问题。如果我们了解这一点,我们就知道如何进行治疗性干预。”一个此前不为人知的关键是一种名为miR-aU14的病毒microRNA。它是启动HHV-6重新激活的枢纽开关。
20. Nature:注射年轻小鼠的脑脊液可提高年老小鼠的记忆力
doi:10.1038/s41586-022-04722-0
在一项新的研究中,来自美国斯坦福大学和德国萨尔兰大学等研究机构的研究人员发现将年轻小鼠的脑脊液注射到年老小鼠中可以导致记忆力的提高。相关研究结果于2022年5月11日在线发表在Nature期刊上,论文标题为“Young CSF restores oligodendrogenesis and memory in aged mice via Fgf17”。在这篇论文中,他们描述了一种从年轻小鼠身上取出少量脑脊液并将它注入年老小鼠的大脑而不造成损害的技术。波士顿儿童医院的Miriam Zawadzki和Maria Lehtine在同期Nature期刊上发表了一篇标题为“Young cerebrospinal fluid improves memory in old mice”的新闻与观点类型文章,概述了这些作者在这项新的研究中所做的研究工作。
近年来,一些科学家一直在吹捧将年轻人的血液输注给老年人作为减缓衰老过程的一种手段的好处。在这项新的研究中,这些作者将这类研究向前推进了一步,他们从一只年轻的小鼠身上取出脑脊液,并将它注射到一只年老小鼠的大脑中,看看这是否可能改善记忆功能。
这些作者花了许多个月的时间寻找一种方法,既能从一只年轻小鼠体内取出少量脑脊液,又不会导致样本被污染。一旦他们做到这一点,他们必须找到一种方法,将这种脑脊液样本注射到一只年老的小鼠体内,而不造成损害或感染。一旦这两种实验流程得到完善,他们就训练一组年老的小鼠,让它们将闪光与对脚的电击联系起来。然后,他们从几只年轻小鼠身上收集了多份脑脊液样本,并将这些样本注射到几只受过训练的年老小鼠的大脑中,他们对对照组也做了同样的事情。两周后,他们对这两组小鼠进行了测试,发现那些接受过脑脊液注射的年老小鼠能更好地记住灯光闪烁时将会发生什么。
21. Nature:利用小分子化合物靶向非编码RNA Xist,有望治疗一系列X连锁疾病
doi:10.1038/s41586-022-04537-z
核糖核酸(RNA)在人类健康中发挥着许多作用。在一项新的研究中,来自麻省总医院等研究机构的研究人员提供了强有力的证据表明RNA也可能成为药物开发的可行靶标。相关研究结果发表在2022年4月7日的Nature期刊上,论文标题为“Targeting Xist with compounds that disrupt RNA structure and X inactivation”。在人类基因组计划确定的大约2万种人类蛋白中,目前几乎所有的药物靶向大约700种疾病相关的蛋白之一。然而,近年来,人们对扩大“药物可靶向的(druggable)”靶标名单以包括RNA的兴趣越来越大。在细胞中,脱氧核糖核酸(DNA)携带表达蛋白的遗传密码。一段DNA被复制,或通过转录成产生编码蛋白的RNA,然后通过翻译产生蛋白。然而,人类基因组产生的绝大部分RNA---98%---是“非编码”的。
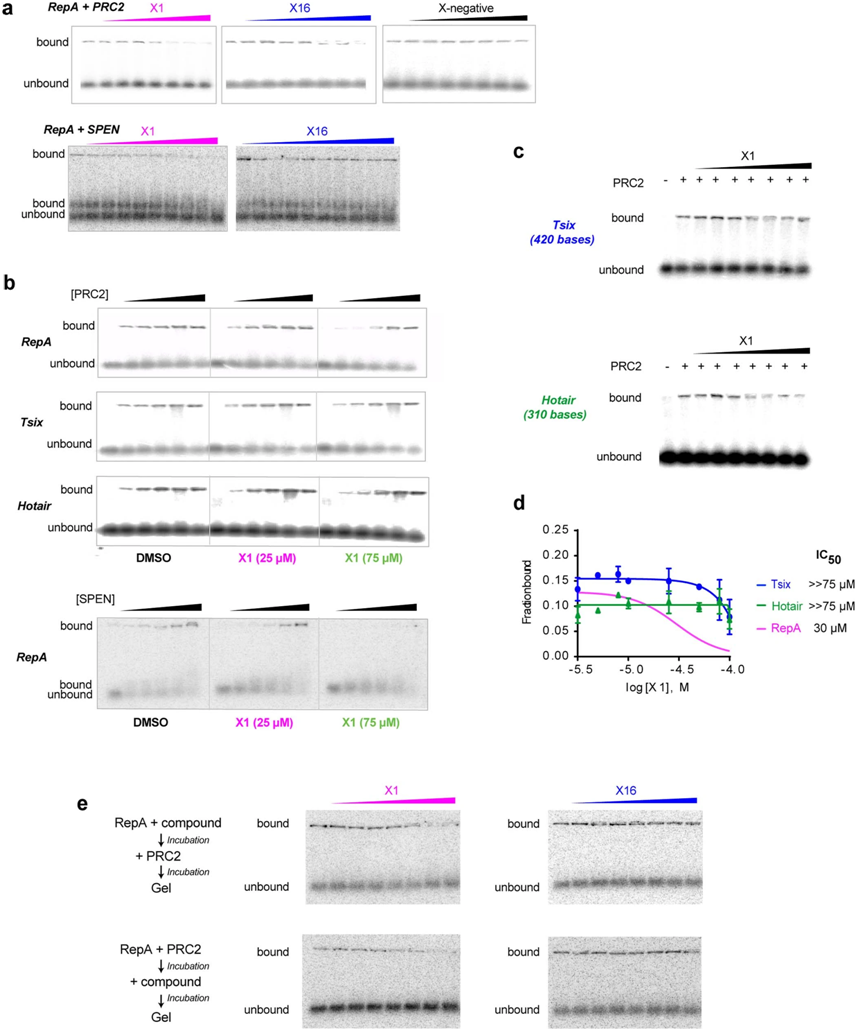
X1在体外抑制Xist RepA与同源相互作用蛋白之间的相互作用。图片来自Nature, 2022, doi:10.1038/s41586-022-04537-z。
论文通讯作者、麻省总医院分子生物学系Jeannie Lee博士说,“这些非编码RNA在基因组中发挥着非常重要的作用,而且我们现在了解到,在这种非编码的基因组区域发生的突变会导致疾病。这些RNA基因可能远远多于蛋白编码基因。如果我们能够靶向这些RNA,我们将极大地增加我们能找到治疗患者的药物的范围。”
然而,制药业历来对追求RNA作为药物靶标犹豫不决。蛋白往往有稳定的形状,或者说构象,这使得它们成为最佳的靶标:药物与蛋白的结合就像钥匙插入锁中。Lee解释说,相比之下,RNA往往是高度灵活的,并且能够拥有多种构象。Lee说,“如果锁不断改变形状,那么钥匙就不会起作用。非编码RNA的不稳定性使得制药公司不愿意投资尝试开发针对它们的药物。然而,人们已知道RNA上的一些区域保持着稳定的构象,但是找到这样的区域一直是一个挑战。”
Lee和和她的团队在麻省总医院研究RNA及其在一种称为X染色体失活(XCI)的生物过程中的作用,其中XCI使得雌性哺乳动物的一个X染色体拷贝失活,是正常发育所必需的。在这项新的研究中,这些作者看看RNA是否可以成为可行的药物靶标。他们的研究重点是一种叫做Xist的非编码RNA,它能使X染色体上的基因沉默。找到一种干扰这一过程并重新激活休眠的X染色体的方法,可能有助于开发治疗由X染色体上的突变引起的遗传疾病(称为X连锁疾病,比如雷特综合征和脆性X综合征)的方法。
22. Nature:重新设计的Cas9版本可让基因编辑更安全
doi:10.1038/s41586-022-04470-1
在人类身上使用基于CRISPR的基因编辑所面临的巨大挑战之一是这种分子机器有时会对宿主基因组的不正确位点进行修改,这就造成了一种可能性,即试图修复基因组中一个位点的基因突变可能会意外地在另一个位点产生危险的新突变。
但是如今,在一项新的研究中,来自美国德克萨斯大学奥斯汀分校的研究人员对一种广泛使用的基于CRISPR的基因编辑工具中的一个关键组件---Cas9---进行重新设计,使得它靶向错误的DNA片段的可能性降低数千倍,同时保持与原始的Cas9版本一样的效率,使得它可能更加安全。相关研究结果于2022年3月2日在线发表在Nature期刊上,论文标题为“Structural basis for mismatch surveillance by CRISPR–Cas9”。论文通讯作者为德克萨斯大学奥斯汀分校分子生物科学教授Kenneth Johnson和德克萨斯大学奥斯汀分校分子生物科学助理教授David Taylor。论文第一作者是博士后Jack Bravo和Mu-Sen Liu。
Johnson说,“就CRISPR/Cas系统在基因编辑中的广泛应用而言,这真地可能会引发变革。”其他实验室已经重新设计了Cas9以减少脱靶相互作用,但到目前为止,所有这些版本都是通过牺牲速度来提高准确性。在这项新的研究中,这些作者开发的Cas9新版本---SuperFi-Cas9---切割脱靶位点的可能性降低了4000倍,但与天然的Cas9一样快。Bravo说,你可以把实验室生成的不同版本的Cas9想象成不同型号的自驾车。大多数模型确实很安全,但它们的最高速度为每小时10英里。
23. Nature:重大突破!我国科学家领衔在世界上首次将人类多能性干细胞转化为8细胞阶段全能性胚胎样细胞
doi:10.1038/s41586-022-04625-0
在一项新的研究中,来自中国科学院和深圳华大基因研究院等研究机构的研究人员在世界上首次宣布发现了一种无转基因、快速和可控的方法,将人类多能性干细胞转化为真正的8细胞阶段全能性胚胎样细胞(8-cell totipotent embryo-like cell),这就为器官再生和合成生物学的进步铺平了道路。相关研究结果于2022年3月21日在线发表在Nature期刊上,论文标题为“Rolling back of human pluripotent stem cells to an 8-cell embryo-like stage”。
这些作者利用华大基因研究院的先进单细胞测序技术来协助将人类多能性干细胞---早期胚胎细胞的“成体”版本---转化为一种更“年幼的”细胞版本,即8细胞阶段全能性胚胎样细胞。这些8细胞阶段全能性胚胎样细胞重现了人类合子基因组的激活,并保留所有具有发育潜力的细胞谱系。这些8细胞阶段全能性胚胎样细胞将来可能能够用于再生医学,以使已经生病的人类器官再生,减少世界对器官捐赠的依赖。它们还可以用来产生人工囊胚或类囊胚。此外,它们将有助于研究人类胚胎发育,帮助治疗与发育有关的早期疾病,还能防止怀孕失败。
虽然这种将多能性干细胞转化为囊胚内的内细胞团样细胞(inner cell mass-like cell)的技术已经存在了一段时间,但是这项研究是科学家们首次建立了让多能性干细胞返回到与8细胞胚胎相匹配的人类发育周期中真正的早期阶段的方法,这将有助于扩大对人类早期胚胎发育的了解。最重要的是,这些作者随后能够证实经过转化后产生的8细胞阶段全能性胚胎样细胞能够在体内产生胎盘细胞---这是世界上第一次做到这一点。
24. Nature:揭示CAR-T细胞可在人体内持续存在至少10年,并实现白血病持续缓解
doi:10.1038/s41586-021-04390-6
2010年夏天,Bill Ludwig和Doug Olson正在与一种叫做慢性淋巴细胞白血病(CLL)的凶恶血癌作斗争。他们都接受了许多治疗,由于剩下的治疗选择越来越少,他们自愿成为美国宾夕法尼亚大学艾布拉姆森癌症中心和佩雷尔曼医学院正在进行的一项实验性疗法临床试验的首批参与者。该疗法将根除他们的晚期白血病,成为全球的头条新闻,并开创一个高度个性化的医学新时代。
在这种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的实验性疗法中,经过基因改造的靶向肿瘤细胞的T细胞是用每名患者自己的T细胞为他们制作的活体药物。如今,在一项新的研究中,来自宾夕法尼亚大学和费城儿童医院的研究人员发表了对这两名患者的分析,解释了CAR-T细胞疗法记录到目前为止对CLL的最长持续时间,并显示CAR-T细胞在输注到患者体内后至少十年仍可检测到,这两名患者的病情持续缓解。相关研究结果于2022年2月2日在线发表在Nature期刊上,论文标题为“Decade-long leukaemia remissions with persistence of CD4+ CAR T cells”。
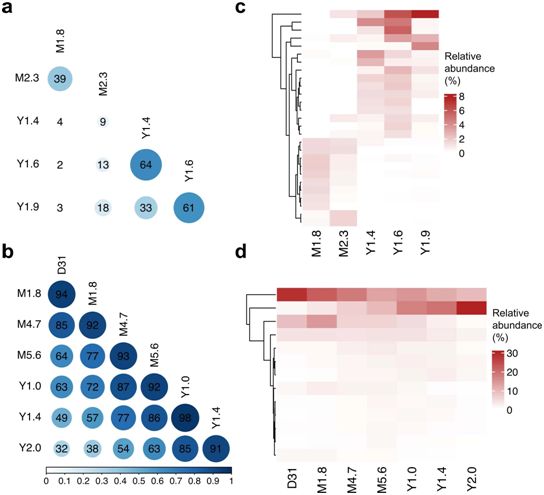
基于T细胞受体测序数据,分析患者1、2体内的CAR-T细胞克隆进化。图片来自Nature, 2022, doi:10.1038/s41586-021-04390-6。
研究者表示,这种长期缓解是了不起的,见证患者无癌生活证明了这种有效对抗癌细胞的‘活体药物’的巨大效力。目睹我们的患者对这种创新的细胞疗法反应良好,我们所有的努力都是值得的。能够让他们有更多的时间生活,并与亲人一起度过。”CLL是宾夕法尼亚大学研究和使用CAR-T细胞的第一种癌症,也是成人最常见的白血病类型。虽然该疾病的治疗已经有所改善,但用标准方法仍然无法治愈。最终,患者会对大多数疗法产生抗药性,许多人仍然死于这种疾病。
25. Nature:重磅!揭示EB病毒导致多发性硬化症机制
doi:10.1038/s41586-022-04432-7
多发性硬化症是一种影响近100万美国人的瘫痪性自身免疫疾病。科学家们长期以来一直怀疑---但未能证明---某些病毒感染与多发性硬化症(multiple sclerosis, MS)的产生之间存在联系。如今,在一项新的研究中,来自美国斯坦福大学医学院等研究机构的研究人员证实作为一种常见的疱疹病毒类型,爱泼斯坦-巴尔病毒(Epstein-Barr virus,也称EB病毒)通过激发免疫系统攻击人体自身的神经系统而引发了多发性硬化症。相关研究结果近期发表在Nature期刊上,论文标题为“Clonally Expanded B Cells in Multiple Sclerosis Bind EBV EBNA1 and GlialCAM”。
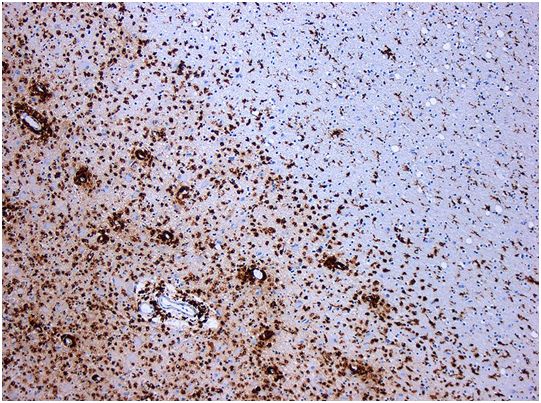
多发性硬化症导致神经元脱髓鞘。CD68染色组织显示病变区域有多个巨噬细胞。图片来自Marvin 101/Wikipedia。
这项研究显示大约20%至25%的多发性硬化症患者的血液中存在与一种来自EB病毒的蛋白(称为EBNA1)和一种在大脑和脊髓中制造的蛋白(称为GlialCAM)紧密结合的抗体,下称MS抗体。研究者William Robinson博士说,“EB病毒蛋白的一部分模拟了人体自身的蛋白---在这种情况下,指的是在位于神经元表面的绝缘髓鞘上发现的GlialCAM。这意味着,当免疫系统攻击EB病毒以清除该病毒时,它最终也会靶向髓鞘中的GlialCAM。”
髓鞘形成了神经细胞周围的保护层,当它被损坏时,电脉冲就不能再从一个神经元有效地跳到另一个神经元,从而导致多发性硬化症中的麻木、肌肉无力和严重疲劳。斯坦福大学医学院神经病学教授Lawrence Steinman博士说,“这是第一次有人相当明确地表明病毒是多发性硬化症的诱因。这些令人兴奋的发现为多发性硬化症的临床试验开辟了一些新的方向。”
- 上一篇
【盘点】2022年终盘点:2022年Cell期刊精华
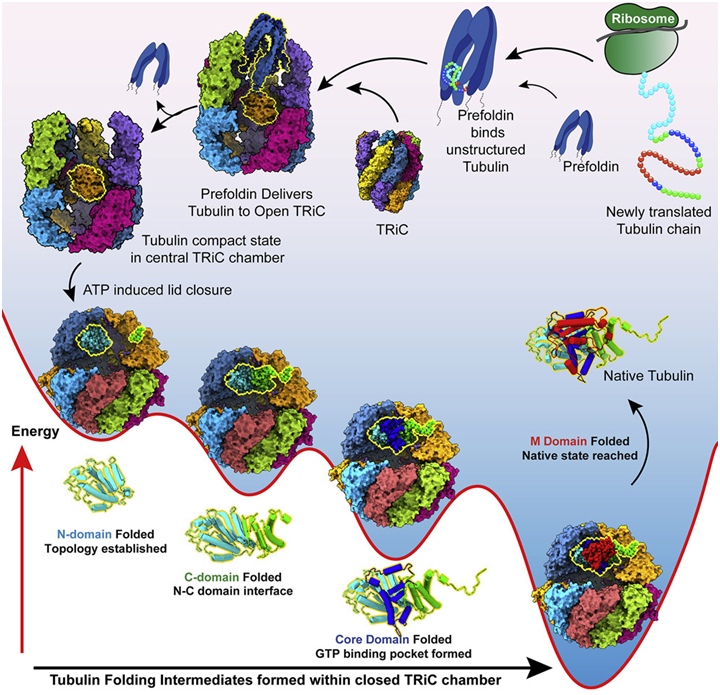
2022年即将结束,在过去的一年里,Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。 1.Cell:里程碑进展!揭示人类伴侣蛋白TRiC指导微管蛋白折叠机制 doi:10.1016/j.cell.2022.11.014 人类微管蛋白(tubulin)是作为细胞支架和运输系统的微管的组成部分。在一项具有里程碑意义的长达10年的研究中,来
- 下一篇

【盘点】2022年终盘点:2022年Science期刊精华
2022年即将结束,在过去的一年里,Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。 1.Science:改写教科书!大肠杆菌的基因表达变化几乎完全发生在细胞生长时的转录阶段 doi:10.1126/science.abk2066 分子生物学的基本原理决定了蛋白是如何在细胞内形成的,这分为两个阶段,即转录和翻译。在转录过程中,储

