Cancer Sci:科学家识别出抵御人类胰腺癌的关键分子靶点
如今,胰腺癌依然是全球人群面临的最致命性的恶性肿瘤之一,由于胰腺导管腺癌(PDAC)患者的5年生存率仅为3%左右,因此在全球范围内PDAC都很难利用外科手术进行治疗,为了开发出新型疗法策略,研究人员就需要在分子水平上更好地理解PDAC的生物学特征。近日,一篇发表在国际杂志Cancer Science上题为“Identification of a novel target of SETD1A histone methyltransferase and the clinical significance in pancreatic cancer”的研究报告中,来自东京医牙大学等机构的科学家们通过研究识别出了一种新型靶向性基因,其或许对于PDAC病例有着很强的临床意义。
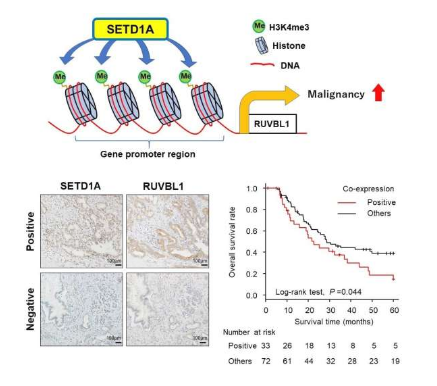
此前研究结果表明,癌细胞能表达一种由SETD1A基因所编码的高水平的特殊酶类—组蛋白H3K4甲基转移酶(histone H3K4 methyltransferase),该酶能通过甲基化化学基团添加到特定靶向性基因的组蛋白(染色质必要的结构组分)上,这一过程就称之为甲基化过程,然而,诱发该酶类过表达以及其对癌细胞效应的分子机制,目前研究人员并不清楚。
当组蛋白发生甲基化后,靶向性基因就会被激活,如果SETD1A的靶向性基因能支持癌症的发育和进展,这一点就特别具有意义,因此,研究人员非常感兴趣理解SETD1A的过表达在PDAC中所扮演的关键角色。研究者Takeshi Ishii说道,尽管此前研究结果表明,SETD1A在多种癌症中处于过表达装填,比如胃癌和肺癌等,但我们并不清楚其在PDAC中的特定分子事件,PDAC中SETD1A的靶向性基因目前尚未被确定或识别。
科学家识别出抵御人类胰腺癌的关键分子靶点。
图片来源:Cancer Science (2022). DOI:10.1111/cas.15615
这项研究中,研究人员在其所分析的51.4%的人类PDAC样本中观察到了高水平SETD1A的表达,他们还确定了SETD1A或许是患者无疾病生存的独立预后因素,这就意味着,当患者机体的肿瘤被切除后,携带高水平SETD1A的患者相比低水平SETD1A的患者而言无疾病状态的持续时间就会变短,相关研究结果也证明了在PDAC中SETD1A表达的临床重要性。
随后,研究人员利用人工培育的PDAC细胞来分析改变SETD1A的表达如何影响机体细胞的行为,当其过表达了SETD1A的水平时,细胞的生长和迁移的能力都会增加;在另外一组PDAC细胞中,研究人员利用分子技术来干扰SETD1A的表达,随后分析了因此而受到影响的其它基因;利用名为RNA测序的特殊技术,研究人员分析了敲低SETD1A的表达后总体的基因表达状况,结果发现,另外一个名为RUVBL1的基因的表达水平也较低。
进一步研究结果表明,SETD1A能使得RUVBL1基因附近的组蛋白甲基化并激活其基因表达,敲低PDAC细胞中RUVBL1的表达或许会产生与之前对SETD1A进行干扰所观察到的相类似的生物学效应,对生存率的分析结果表明,携带高水平SETD1A和RUVBL1的PDAC患者的总体生存率较低,这就表明,其共同表达是指示这种癌症的重要预后生物标志物。综上,本文研究结果提供了对PDAC中SETD1A和RUVBL1表达意义更为深入的理解,同时还提供了关键的细节来帮助临床医生对经历严重疾病的患者制定关键的临床治疗决策。(Bioon.com)
原始出处:
Takeshi Ishii,Yoshimitsu Akiyama,Shu Shimada, et al. Identification of a novel target of SETD1A histone methyltransferase and the clinical significance in pancreatic cancer, Cancer Science (2022). DOI: 10.1111/cas.15615
- 上一篇

衰老不可避免,但如何“健康变老”?
一项新的研究旨在通过对7000多名加拿大中老年人进行大约三年的跟踪调查,揭示有助于成功或最佳衰老的关键因素。研究人员发现,保持良好的健康状况,避免认知、身体或情绪问题致残的可能性更大的人群是女性、已婚、积极锻炼、不肥胖、收入较高、从不吸烟、没有失眠、心脏病或关节炎。 研究结果强调了以力量为基础,而不是以赤字为基础,关注老龄化和老年人
- 下一篇

Eur Heart J:膳食补充剂三癸酰甘油可显著使动脉粥样硬化消退
当我们小的时候,我们的父母告诉我们要吃维生素,这样我们才能长得又大又壮。如今,在一项新的研究中,来自日本大阪大学的研究人员发现一种膳食补充剂可以极大地逆转一部分患者的心脏病迹象。相关研究结果于2022年12月30日在线发表在European Heart Journal期刊上,论文标题为“Remarkable regression of diffu

