Gut:暨南大学张冬梅等团队揭示结直肠癌肝转移的分子机制
9月7日,暨南大学张冬梅,叶文才,陈敏锋及瑞典卡罗林斯卡医学院曹义海在Gut上发表了一篇题为“Novel TCF21high pericyte subpopulation promotes colorectal cancer metastasis by remodelling perivascular matrix ”的研究论文。该研究揭示了肿瘤周细胞在血源性转移中的作用,并为结直肠癌转移提供了潜在的诊断标志物和治疗靶点。

https://gut.bmj.com/content/early/2022/09/06/gutjnl-2022-327913
研究背景
结直肠癌肝转移由血源性传播引起,指肿瘤细胞渗入循环并从血管外渗,随后在肝脏中形成转移灶。肿瘤内渗是血源性转移的关键和限速步骤,在此期间,肿瘤细胞侵入血管周围细胞外基质(ECM),破坏内皮屏障并进入血液循环。在侵入期间,入侵的肿瘤细胞接触内皮细胞和免疫细胞以形成肿瘤转移微环境(TMEM)。
周细胞是嵌在毛细血管壁内、包裹在内皮细胞周围的收缩细胞,是内皮细胞的监督者,调节血管的稳定性和通透性。然而,肿瘤周细胞(TPCs)在血源性转移中的作用仍存在争议。
附着在内皮细胞上的TPCs是抑制肿瘤细胞内渗的生理屏障。NG2+ 或 PDGFRβ+ 周细胞的基因缺失或药物抑制周细胞募集已被证明可增强血管通透性和瘤内缺氧,从而促进肿瘤细胞上皮-间质转化(EMT)和肿瘤转移。肿瘤衍生的PDGF-BB诱导细胞周-成纤维细胞转换(PFT),导致细胞从血管中分离或分泌白细胞介素-33招募肿瘤相关巨噬细胞,增强血源性转移。肿瘤来源的外泌体激活周细胞中的KLF4,导致细胞脱离、纤连蛋白在次级器官中大量沉积,从而建立一个转移前生态位以促进血源性转移。
然而,肿瘤周细胞也起着促转移作用。在原发性肿瘤中,CD45-VLA-1bri或表达内胚层的周细胞通过细胞接触依赖的方式促进肿瘤细胞内渗,而不改变肿瘤的血管结构或通透性,从而促进血源性转移。尚未确定TPCs对血源性转移的相互矛盾的影响是否与它们的异质性有关。
研究概略
研究人员采用单细胞RNA测序(scRNA-seq)剖析了来自结直肠癌患者伴或不伴肝转移的肿瘤周细胞的异质性,并鉴定出13个不同的TPC亚群。其中,一个新的TCF21high TPCs子集,被命名为基质周细胞,与肝转移相关。
通过进一步分析,研究人员发现TPCs中的TCF21增加血管周围胶原沉积和重排以及基底膜降解,促进血管周围转移微环境(PMM)的建立以增强肿瘤细胞内渗。而敲除结直肠癌小鼠的TCF21,能够减少血管周围ECM重塑,维持了基底膜完整性且减少循环肿瘤细胞(CTC),最终抑制了肝转移。
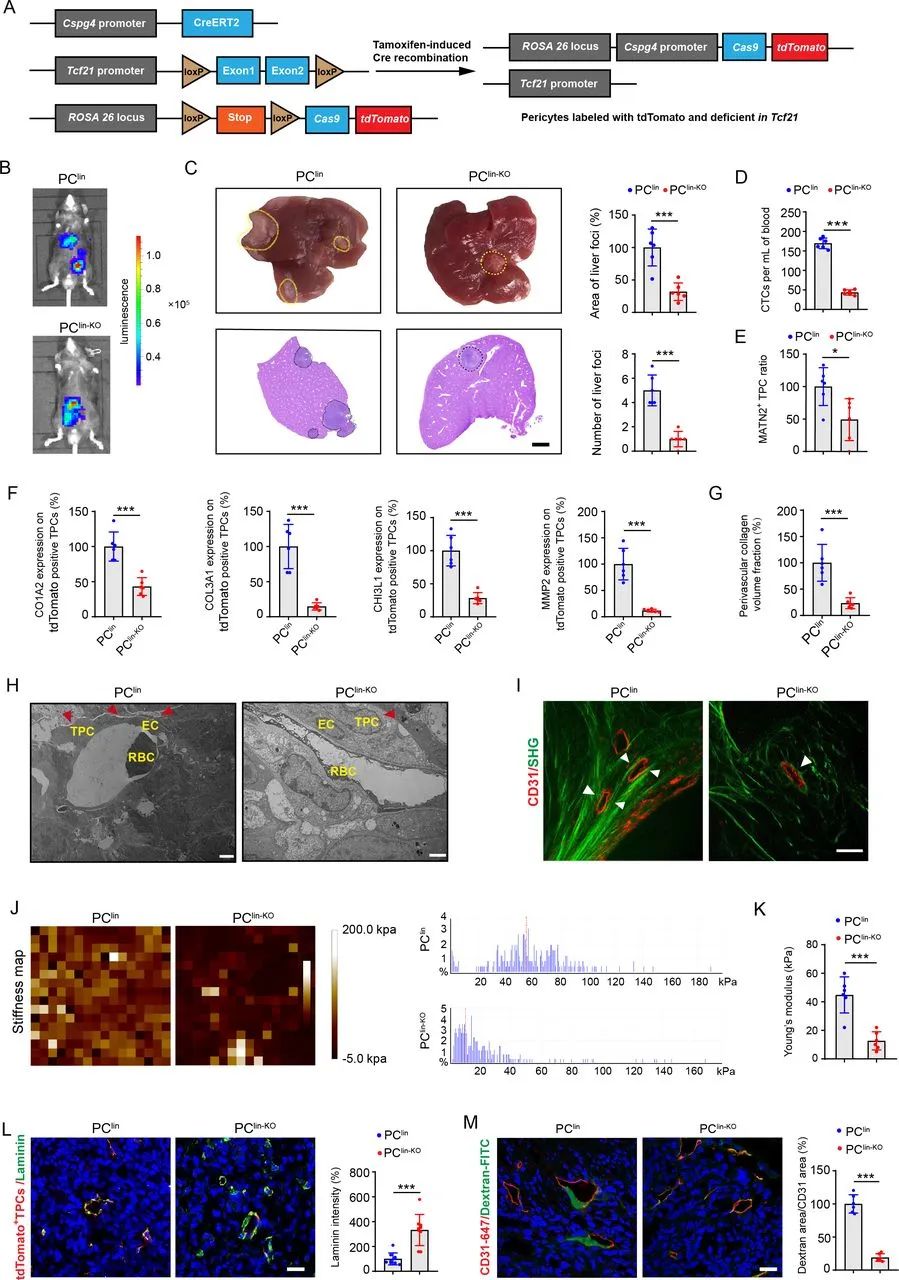
敲除TPCs中的Tcf21可抑制CRC转移
更进一步分析,整合素是ECM成分的关键受体,其作为机械转导促进肿瘤转移。研究人员对此进行了功能获得和功能丧失实验,发现整合素α5在mRNA和蛋白水平上均负调控TCF21。
TCF21 DNA的高甲基化能够抑制多种类型肿瘤细胞中TCF21的表达,包括非小细胞肺癌、头颈部鳞状细胞癌和结直肠癌。而整合素α5通过FAK/PI3K/AKT-DNMT1轴促进TCF21的DNA高甲基化。
研究总结
总之,研究使用了scRNA-seq揭示了结直肠癌患者肿瘤周细胞的异质性,并确定了一个新的与肝转移相关的TCF21high TPCs。这些发现揭示了TCF21high TPCs在PMM构建中通过重构血管周围细胞外基质促进结直肠癌转移的作用和机制,并为血源性转移提供了一个潜在的诊断标志物。
参考资料:
https://gut.bmj.com/content/early/2022/09/06/gutjnl-2022-327913
- 上一篇

European Radiology:基于CT放射组学特征的结直肠癌无创预测
研究发现,结直肠癌(CRC)可由许多遗传和表观遗传事件同时驱动,其死亡率在全球范围内位居第三。微卫星不稳定性(MSI)是一个主要的致癌因素,定义为短串联重复DNA序列(微卫星)的普遍不稳定性,在大约15%的CRC病例中发生。许多研究已经证实,MSI是诊断林奇综合征的一个重要生物标志物,可用于预测CRC患者的治疗反应和预后。 现阶段,国家综合癌症网络指南推荐对
- 下一篇
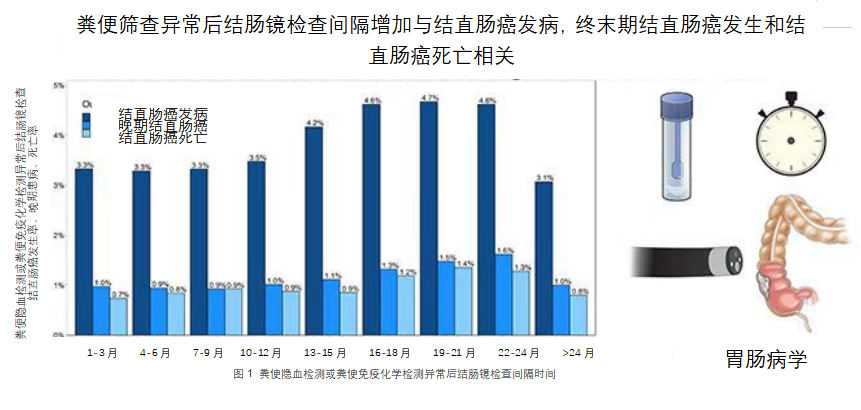
粪便筛查异常应尽早做肠镜检查
结直肠癌是美国成年人第二大癌症相关死亡原因,研究显示癌症筛查可降低结直肠癌相关发生率和死亡率1,2。美国预防服务工作组推荐了几种结直肠癌预防和早期发现的筛查方式,包括粪便免疫学检测和粪便隐血检测2。这两种测试均为无创检测,尤其是在当今新冠全球大流行的状况下,粪便免疫学检测逐渐增多3,4。若无创检查异常还需要进行诊断性结肠镜检查。然而何时进行诊断性结直肠镜检查

