肝癌药物Namodenoson在罗马尼亚获批作为同情用药治疗晚期肝癌
制药公司Can-Fite BioPharma宣布,旗下在研肝癌药物Namodenoson在罗马尼亚获批作为同情用药治疗晚期肝癌患者,已有一位接受治疗的患者完全缓解,全身的转移灶全都消失。
很多肝癌药物都只能用于肝功能较好、Child-Pugh评分为A级的患者,而对肝功能处于临界状态的B级患者和处于失代偿状态的C级患者效果不佳。例如,目前肝癌一线治疗的索拉非尼,治疗Child-Pugh评分为A级的患者,中位生存期能有13个月,而B级患者只有4.5个月。
不同于以往肝癌药物的研究主要在肝功能较好、Child-Pugh评分为A级(5~6分)的患者中进行,Namodenoson的研究还纳入了肝功能已经处于临界状态的B级(7~9分)患者,可以让更多的肝癌患者获益。
Namodenoson 是一种小型口服生物可利用药物,可特异性结合 A3 腺苷受体 (A3AR),在肝癌中过度表达,但在正常细胞中不表达,目前正进入肝癌 III 期关键试验。 该试验已获得美国 FDA 和欧洲药品管理局 (EMA) 的批准,现已开放招募约 450 名被诊断患有肝细胞癌 (HCC) 和潜在的 Child Pugh B7 (CPB7) 的患者,这些患者尚未做出反应 其他批准的疗法。 一名继续接受 Namodenoson 治疗的先前 II 期 HCC 研究患者存活了五年多,并清除了所有癌症病变。
在此前的II期临床试验中,共有78名Child-Pugh评分为B级的晚期肝细胞癌患者接受了Namodenoson或安慰剂的治疗。由于全部9名Child-Pugh评分为9的患者都被意外分到了Namodenoson组,两组患者的中位总生存期分别为4.1个月和4.3个月,没有显著差距。
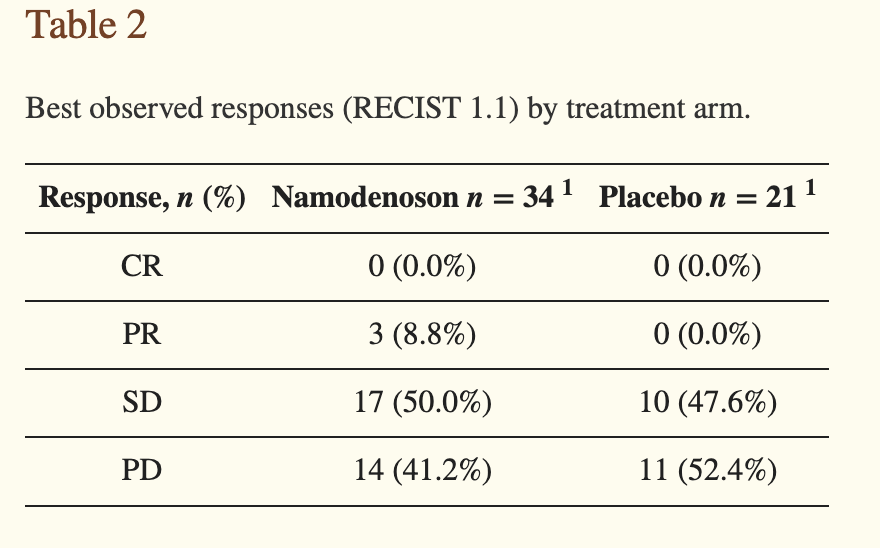
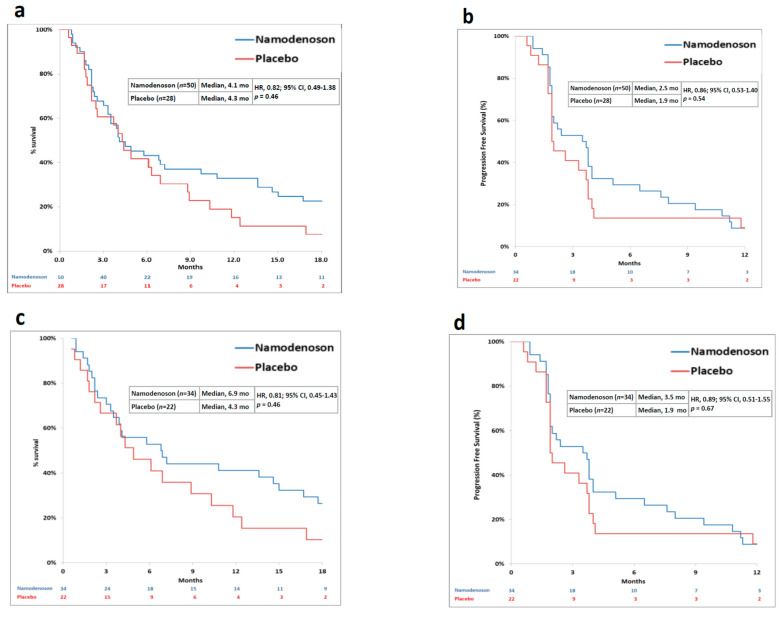
图:所有患者和 Child-Pugh B7 (CPB7) 患者的治疗组 (namodenoson 25 mg/kg 每天两次 (BID) 和安慰剂) 的 Kaplan-Meier 曲线。 (a) 所有患者的总生存期 (OS); (b) 所有患者的无进展生存期 (PFS); (c) CPB7 患者的 OS; (d) CPB7 患者的 PFS。
不过在Child-Pugh评分为7的亚组中,Namodenoson组的1年生存率达到了44%,显著高于安慰剂组的18%,中位总生存期和中位无进展生存期也都有高于安慰剂组的趋势。
另外,试验中有55名患者进行了反应评估。Namodenoson组进行了评估的34名患者中,3人部分缓解,17人疾病稳定,客观缓解率8.8%,疾病控制率58.8%。而安慰剂组参与评估的21名患者只有10人达到了疾病稳定,客观缓解率0%,疾病控制率47.6%。
安全性上,Namodenoson的表现相当良好,不良反应的发生率与安慰剂相当。试验中没有因Namodenoson导致的死亡、停药或剂量减少事件,Namodenoson的治疗也没有产生肝毒性或肝功能异常。整个研究期间,Namodenoson导致的3级及以上不良反应只有1起3级的低钠血症。
目前,Namodenoson已经获得了FDA授予的孤儿药资格和快速通道资格,正在进行III期临床研究。
与此同时,Can-Fite 在晚期肝癌(肝细胞癌)患者中开展的关键 III 期研究已向患者开放招募,并将在以色列、美国和欧洲五个国家招募患者。这项关键研究获得了美国食品药品监督管理局 (FDA) 和欧洲药品管理局 (EMA) 的“绿灯”,如果成功结束,公司将能够提交该药物以供双方批准的监管部门。 Namodenoson 具有 FDA 和 EMA 的孤儿药状态以及 FDA 的快速通道状态。注册计划已提交给 FDA 并被 FDA 接受。
“腺苷通路靶点已成为临床验证最多的肿瘤学通路之一,进一步验证了我们用于治疗肝癌和其他癌症的 A3AR 靶点。 我很高兴受邀发言并分享 Can-Fite 在腺苷途径药物开发和临床试验方面的经验,以及显示接受 Namodenoson 治疗并完全康复的患者肿瘤病变消失的放射学数据,”Can 说 -Fite 首席执行官 Pnina Fishman 博士。
“我们致力于在迄今为止的临床试验中为该患者群体提供具有出色安全性和强大疗效的 Namodenoson,以满足迫切未满足的医疗需求。 Namodenoson 的抗癌作用及其肝脏保护特性使其在针对这种破坏性疾病的抗癌药物中独树一帜,”Can-Fite 首席执行官 Pnina Fishman 博士说。
根据 DelveInsight 的数据,到 2027 年,G8 国家的肝细胞癌 (HCC) 药物市场预计将达到 38 亿美元。美国癌症协会估计,在美国,肝癌发病率自 1980 年以来增加了两倍,估计每年诊断出 41,000 例病例和 31,000 例死亡。其他国家的肝癌发病率要高得多,全球每年估计有超过 800,000 例诊断和 700,000 例死亡。
另外,Namodenoson针对非酒精性脂肪肝的临床试验也正在进行中。这项 II 期随机试验研究了 A3 腺苷受体激动剂 namodenoson 治疗伴有或不伴有 NASH 的 NAFLD 的疗效和安全性。 共有 60 名患者接受了 namodenoson(12.5 mg 或 25 mg)或安慰剂治疗 12 周; 主要疗效终点为 ALT 改善。 与安慰剂组相比,namodenoson (25 mg) 组的血清 ALT 水平变化有显着性趋势 (P = .066)。 与安慰剂组相比,namodenoson (25 mg) 组的血清 AST 水平在 12 周时显着下降 (P = .03)。
参考资料:
https://ir.canfite.com/news-events/press-releases/detail/997/can-fites-drug-namodenoson-approved-for-compassionate
Granito A, Bolondi L. Non-transplant therapies for patients with hepatocellular carcinoma and Child-Pugh-Turcotte class B cirrhosis[J]. The Lancet Oncology, 2017, 18(2): e101-e112.
Hollebecque A, Cattan S, Romano O, et al. Safety and efficacy of sorafenib in hepatocellular carcinoma: the impact of the Child‐Pugh score[J]. Alimentary pharmacology & therapeutics, 2011, 34(10): 1193-1201.
Cohen S, Stemmer S M, Zozulya G, et al. CF102 an A3 adenosine receptor agonist mediates anti‐tumor and anti‐inflammatory effects in the liver[J]. Journal of cellular physiology, 2011, 226(9): 2438-2447.
Stemmer S M, Manojlovic N S, Marinca M V, et al. Namodenoson in advanced hepatocellular carcinoma and child–pugh B cirrhosis: Randomized placebo-controlled clinical trial[J]. Cancers, 2021, 13(2): 187.
https://www.businesswire.com/news/home/20220823005373/en/Can-Fite%E2%80%99s-Drug-Namodenoson-Approved-for-Compassionate-Use-Treatment-of-Advanced-Liver-Cancer-Patients-in-Romania
Aliment. Pharmacol. Ther. 2021 Dec 01;54(11-12)1405-1415
Cancers (Basel). 2021 Jan; 13(2): 187.
- 上一篇
仅30年,这种肝炎相关的肝癌发病率已翻倍!(不是乙肝)
脂肪性肝病(NAFLD)包括一系列疾病,包括具有良性临床病程的简单脂肪变性,以及可进一步进展为晚期肝病的非酒精性脂肪性肝炎(NASH),可进一步进展为晚期肝脏疾病,包括肝硬化和肝细胞癌(HCC)。据估计,25%的美国普通人群受到NAFLD的影响,其中20~25%将进展为NASH,4~11.3%的NASH患者最终患上肝癌(LC)。在糖尿病和代谢综合征的增加同时
- 下一篇

Sci Rep:不愧为「癌中天使」?曾得甲状腺癌的人再得肝癌,死亡风险竟减半!
原发性肝癌(PLC)是全球第四大癌症相关死亡的主要原因。尽管治疗手段取得了巨大进步,但PLC的5年生存率从5%到30%不等。在过去的20年里,肝癌一直是死亡率增加最大的肿瘤,发病率的稳步上升和高死亡率引起了人们的关注。随着癌症治疗的发展和早期诊断率的提高,长期癌症幸存者的数量持续上升。更好的生存预期增加了癌症幸存者发生第二原发性恶性肿瘤的可能性,迫切需要了解

